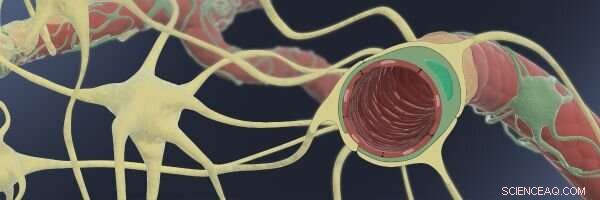
Questa illustrazione mostra come nella barriera emato-encefalica (BBB), sottili capillari endoteliali (rossi) sono avvolti da periciti di sostegno (verdi) e astrociti (gialli), consentendo loro di generare una barriera stretta con funzioni di trasporto altamente selettive per le molecole che entrano nel fluido cerebrale dal flusso sanguigno. Credito:Wyss Institute presso l'Università di Harvard
Come le barriere di sicurezza aeroportuali che eliminano i viaggiatori autorizzati o impediscono ai viaggiatori non autorizzati e ai loro bagagli di accedere alle aree operative centrali, la barriera emato-encefalica (BBB) controlla strettamente il trasporto di nutrienti essenziali e metaboliti energetici nel cervello e allontana le sostanze indesiderate che circolano nel flusso sanguigno. È importante sottolineare che la sua struttura altamente organizzata di sottili vasi sanguigni e cellule di supporto è anche il principale ostacolo che impedisce ai farmaci salvavita di raggiungere il cervello per curare efficacemente il cancro, neurodegenerazione, e altre malattie del sistema nervoso centrale. In un certo numero di malattie del cervello, la BBB può anche rompersi localmente, provocando sostanze neurotossiche, cellule del sangue e agenti patogeni per penetrare nel cervello e provocare danni irreparabili.
Per studiare la BBB e il trasporto di droga attraverso di essa, i ricercatori si sono principalmente affidati a modelli animali come i topi. Però, le precise funzioni di trucco e trasporto dei BBB in quei modelli possono differire significativamente da quelle dei pazienti umani, che li rende inaffidabili per la previsione della somministrazione dei farmaci e dell'efficacia terapeutica. Anche i modelli in vitro che tentano di ricreare la BBB umana utilizzando cellule primarie derivate dal tessuto cerebrale finora non sono stati in grado di imitare la barriera fisica della BBB, funzioni di trasporto, e attività di trasporto di farmaci e anticorpi abbastanza vicine da essere utili come strumenti di sviluppo terapeutico.
Ora, un team guidato da Donald Ingber, M.D., dottorato di ricerca presso il Wyss Institute for Biologically Inspired Engineering di Harvard ha superato questi limiti sfruttando la sua tecnologia microfluidica Organs-on-Chips (Organ Chips) in combinazione con un approccio che imita l'ipossia ispirato allo sviluppo per differenziare le cellule staminali pluripotenti umane (iPS) in cellule endoteliali microvascolari cerebrali cellule (BMVEC). Il risultante "Chip BBB potenziato dall'ipossia" ricapitola l'organizzazione cellulare, funzioni di barriera stretta e capacità di trasporto della BBB umana; e consente il trasporto di farmaci e anticorpi terapeutici in un modo che imita più da vicino il trasporto attraverso la BBB in vivo rispetto ai sistemi in vitro esistenti. Il loro studio è riportato in Comunicazioni sulla natura .
"Il nostro approccio alla modellazione di farmaci e anticorpi che attraversano la BBB umana in vitro con una fedeltà così elevata e senza precedenti rappresenta un progresso significativo rispetto alle capacità esistenti in questa area di ricerca estremamente impegnativa, " ha affermato Ingber, direttore fondatore del Wyss Institute. "Risponde a un'esigenza critica nei programmi di sviluppo di farmaci in tutto il mondo farmaceutico e biotecnologico che ora miriamo a superare con un 'Programma di trasporto della barriera sangue-cervello' dedicato presso il Wyss Institute utilizzando il nostro talento unico e risorse." Ingber è anche Judah Folkman Professor of Vascular Biology presso HMS e Vascular Biology Program presso il Boston Children's Hospital, nonché Professore di Bioingegneria presso SEAS.
La BBB è costituita da sottili vasi sanguigni capillari formati da BMVEC, cellule multifunzionali note come periciti che si avvolgono intorno all'esterno dei vasi, e astrociti a forma di stella, che sono cellule cerebrali non neuronali che contattano anche i vasi sanguigni con processi simili a piedi. In presenza di periciti e astrociti, le cellule endoteliali possono generare la barriera della parete del vaso ermeticamente sigillata tipica della BBB umana.
Il team di Ingber ha prima differenziato le cellule iPS umane in cellule endoteliali cerebrali nel piatto di coltura utilizzando un metodo che era stato precedentemente sviluppato dal coautore Eric Shusta, dottorato di ricerca, Professore di Ingegneria Chimica e Biologica presso l'Università del Wisconsin-Madison, ma con il potere aggiunto della bioispirazione. "Perché nell'embrione, la BBB si forma in condizioni di basso contenuto di ossigeno (ipossia), abbiamo differenziato le cellule iPS per un lungo periodo in un'atmosfera con solo il 5% invece del normale 20% di concentrazione di ossigeno, " ha detto il co-primo autore Tae-Eun Park, dottorato di ricerca "Di conseguenza, le cellule iPS hanno avviato un programma di sviluppo molto simile a quello dell'embrione, producendo BMVEC che hanno mostrato una funzionalità superiore rispetto ai BMVEC generati in condizioni normali di ossigeno." Park è stato un borsista post-dottorato nel team di Ingber e ora è Assistant Professor presso l'Ulsan National Institute of Science and Technology nella Repubblica di Corea.

Nel chip BBB umano potenziato, cellule endoteliali derivate da cellule staminali pluripotenti umane indotte in un processo ispirato allo sviluppo, formare un microrecipiente nella parte inferiore di due canali microfluidici paralleli (immagini inferiori), mentre i periciti e gli astrociti che popolano il canale superiore si collegano al microvaso attraverso una membrana porosa divisoria. Credito:Wyss Institute presso l'Università di Harvard
Basandosi su un precedente modello BBB umano, i ricercatori hanno poi trasferito i BMVEC umani indotti dall'ipossia in uno dei due canali paralleli di un dispositivo Organ-on-Chip microfluidico che sono divisi da una membrana porosa e continuamente perfusi con il mezzo. L'altro canale era popolato con una miscela di periciti e astrociti primari del cervello umano. Dopo un giorno aggiuntivo di trattamento dell'ipossia, il chip BBB umano potrebbe essere mantenuto stabilmente per almeno 14 giorni a normali concentrazioni di ossigeno, che è molto più lungo dei precedenti modelli BBB umani in vitro tentati in passato.
Sotto lo sforzo di taglio dei fluidi che perfondono il chip BBB, i BMVEC continuano a formare un vaso sanguigno, e sviluppare un'interfaccia densa con i periciti allineandosi con loro sull'altro lato della membrana porosa, così come con gli astrociti che estendono processi verso di loro attraverso piccole aperture nella membrana. "La distinta morfologia del BBB ingegnerizzato è parallela alla formazione di una barriera più stretta contenente un numero elevato di sistemi di trasporto selettivo e di navetta dei farmaci rispetto ai BBB di controllo che abbiamo generato senza ipossia o stress da taglio del fluido, o con endotelio derivato da cervello adulto invece di cellule iPS, " disse Nur Mustafaoglu, dottorato di ricerca, un co-primo autore dello studio e Postdoctoral Fellow che lavora nel team di Ingber. "Inoltre, potremmo emulare gli effetti delle strategie di trattamento nei pazienti in clinica. Per esempio, abbiamo aperto in modo reversibile la BBB per un breve periodo aumentando la concentrazione di un soluto di mannitolo [osmolarità] per consentire il passaggio di farmaci di grandi dimensioni come l'anticorpo antitumorale Cetuximab".
Per fornire ulteriori prove che il chip BBB umano potenziato dall'ipossia può essere utilizzato come strumento efficace per studiare la somministrazione di farmaci al cervello, il team ha studiato una serie di meccanismi di trasporto che impediscono ai farmaci di raggiungere i loro bersagli nel cervello pompandoli nuovamente nel flusso sanguigno (efflusso), o quello, in contrasto, consentono il trasporto selettivo di nutrienti e farmaci attraverso la BEE (transcitosi).
"Quando abbiamo bloccato specificamente la funzione della P-gp, una pompa di efflusso endoteliale chiave, potremmo aumentare sostanzialmente il trasporto del farmaco antitumorale doxorubicina dal canale vascolare al canale cerebrale, molto simile a quanto osservato nei pazienti umani, " disse Park. "Così, il nostro sistema in vitro potrebbe essere utilizzato per identificare nuovi approcci per ridurre l'efflusso e quindi facilitare il trasporto di farmaci nel cervello in futuro".
In un'altra sede, gli sviluppatori di farmaci stanno cercando di sfruttare la "transcitosi mediata dai recettori" come veicolo per la spola di nanoparticelle caricate di farmaci, farmaci chimici e proteici più grandi, così come anticorpi terapeutici attraverso la BBB. "Il chip BBB umano potenziato dall'ipossia ricapitola la funzione dei percorsi critici di transcitosi, come quelli usati dall'LRP-1 e dai recettori della transferrina responsabili dell'assorbimento delle lipoproteine vitali e del ferro dal sangue circolante e del loro rilascio nel cervello dall'altra parte della BEE. Sfruttando quei recettori utilizzando diverse strategie precliniche, possiamo imitare fedelmente la spola precedentemente dimostrata di anticorpi terapeutici che prendono di mira i recettori della transferrina in vivo, pur mantenendo l'integrità della BBB in vitro, ", ha detto Mustafaoglu.
Sulla base di questi risultati, il Wyss Institute ha avviato un "Programma di trasporto della barriera sangue-cervello". "Inizialmente, il programma BBB Transport mira a scoprire nuovi bersagli navetta che si arricchiscono sulla superficie vascolare BMVEC, utilizzando nuove trascrittomiche, proteomica, e approcci cellulari iPS. In parallelo, stiamo sviluppando navette anticorpali completamente umane dirette contro bersagli navetta noti con capacità di targeting cerebrale potenziate, " ha detto James Gorman, M.D., dottorato di ricerca, il capo del personale per il programma di trasporto BBB che lavora con Ingber. "Miriamo a collaborare con più partner biofarmaceutici in una relazione precompetitiva per sviluppare navette che offrano un'efficacia eccezionale e flessibilità ingegneristica per l'incorporazione in farmaci anticorpali e proteici, perché questo è così tanto necessario dai pazienti e dall'intero campo".
Gli autori ritengono che oltre agli studi sullo sviluppo dei farmaci, il chip BBB umano potenziato dall'ipossia può essere utilizzato anche per modellare aspetti delle malattie cerebrali che colpiscono la BBB come l'Alzheimer e il morbo di Parkinson, e ad approcci avanzati di medicina personalizzata utilizzando cellule iPS derivate dal paziente.