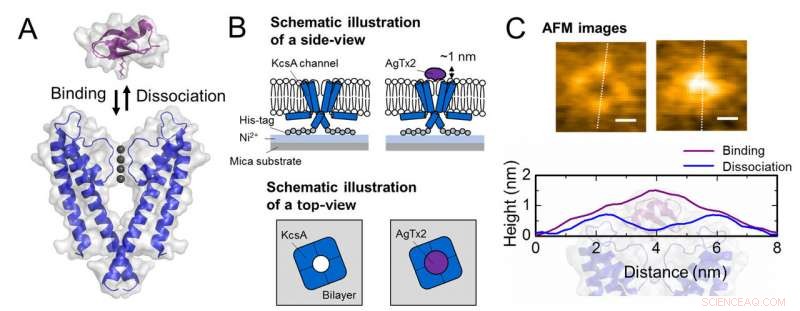
Schema di associazione e dissociazione del canale del potassio KcsA (Q58A/T61S/R64D) e AgTx2 e immagini AFM rappresentative. A. Associazione (vincolante) di KcsA e AgTx2. B. Schema che mostra un esemplare per l'osservazione AFM.
C. Immagini AFM rappresentative e con le dimensioni mostrate come linee tratteggiate bianche. Sbarra, 2 nm. Credito:Università di Kanazawa
L'agitossina-2 (AgTx2) del veleno dello scorpione è un potente bloccante dei canali K+. I ricercatori hanno ora osservato le dinamiche di legame di AgTx2 al canale KcsA utilizzando la microscopia a forza atomica ad alta velocità. Le analisi cinetiche della singola molecola hanno rivelato che l'affinità del canale per AgTx2 è aumentata durante il legame persistente e diminuita durante la dissociazione persistente. I ricercatori propongono un modello a quattro stati con costanti di velocità rilevanti. Un percorso di adattamento indotto era dominante e accelerava il legame di 400 volte.
Le membrane cellulari contengono canali ionici che regolano la permeazione di vari ioni tra l'interno e l'esterno della cellula. I canali ionici sono proteine, e in risposta a stimoli diversi, permettono a ioni specifici di permeare. In questo modo la cellula regola i segnali elettrici che sono alla base della funzione dei muscoli e del sistema nervoso. Poiché un malfunzionamento dei canali ionici provoca una serie di disturbi come infarto del miocardio ed epilessia, è importante comprendere il meccanismo d'azione delle molecole che ostacolano le funzioni dei canali ionici.
È stato scoperto che il veleno dello scorpione contiene più di 200 composti che si legano ai canali K+. Tra loro, AgTx2 è un peptide costituito da 38 residui di amminoacidi. Studi precedenti hanno mostrato che legandosi al canale K+ dall'esterno della membrana cellulare, AgTx2 blocca il poro del canale K+ e inibisce la permeazione del K+. Però, il meccanismo molecolare dettagliato è rimasto sconosciuto, per esempio. se le dinamiche di legame potrebbero essere spiegate da un modello a due stati di associazione e dissociazione.
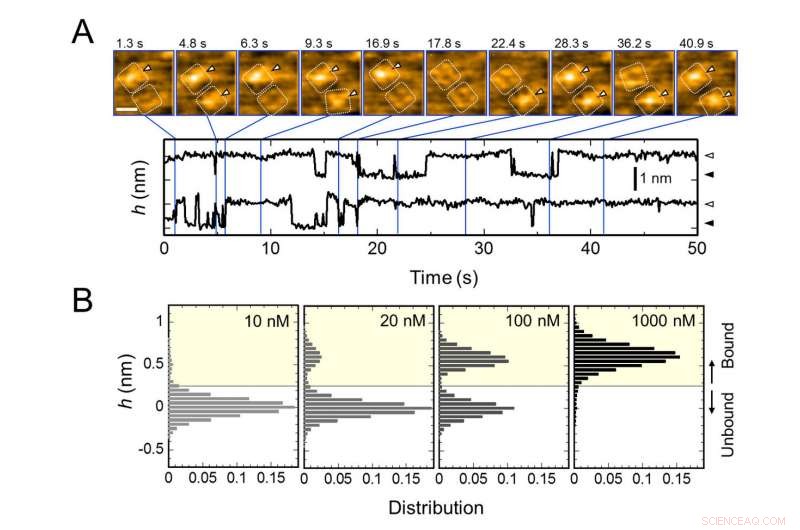
Legame ripetitivo di AgTx2 al canale del potassio KcsA e AgTx2 - dipendenza dalla concentrazione della probabilità di legame. A. Immagini time-lapse del legame e della dissociazione di AgTx2 dai canali KcsA e l'andamento temporale dell'altezza media (h) (nm) attorno al centro della superficie extracellulare. Barra della scala nell'immagine HS-AFM, 5 nm. B. Istogrammi dell'altezza di h in funzione della concentrazione di AgTx2 nella soluzione. Credito:Università di Kanazawa
Il gruppo di ricerca, compresi scienziati dell'Università di Kanazawa, visualizzato l'associazione e la dissociazione di AgTx2 con il canale K+ KcsA utilizzando la microscopia a forza atomica ad alta velocità (HS-AFM) e ha eseguito un'analisi dettagliata della dinamica (Figura 1). KcsA è un tetramero, le sue subunità formano una struttura ad anello. Quando AgTx2 si lega alla superficie del tetramero, la parte centrale del canale, cioè il passaggio per K+, sembrava gonfio a causa del legame AgTx2. Il legame e la dissociazione di AgTx2 al canale K+ potrebbe avvenire ripetutamente e l'altezza attorno al centro del canale è cambiata di conseguenza (Figura 2).
Quando la concentrazione di AgTx2 nella soluzione era alta, anche la probabilità di legame era alta. I tempi del legame e della dissociazione hanno rivelato che al legame di AgTx2 a KcsA, la conformazione di KcsA è cambiata, che ha permesso ad AgTx2 di legarsi più facilmente, e che anche dopo dissociazione di AgTx2, un'altra molecola AgTx2 potrebbe legarsi a KcsA molto rapidamente; questo è indicato come un meccanismo di adattamento indotto. D'altra parte, è stato osservato che, quando è trascorso un tempo sufficiente dopo la dissociazione di AgTx2, la conformazione di KcsA è tornata all'originale, a cui AgTx2 si legava meno facilmente.
Questi risultati indicano che le dinamiche di legame non possono essere spiegate con un semplice modello a due stati, cioè legame e dissociazione. Sembrava che sia lo stato di associazione che quello di dissociazione di KcsA potessero essere distinti come almeno due sottostati; è stato quindi considerato un modello associativo a quattro stati (Figura 3). Quando le velocità di reazione sono state calcolate per un modello a quattro stati, le velocità ottenute riflettevano quelle ottenute sperimentalmente. Una simulazione delle dinamiche di legame con questo modello a quattro stati e le velocità di reazione associate, ha mostrato che il legame di AgTx2 avviene principalmente attraverso la via di adattamento indotto. Ulteriore, è stato scoperto che l'adattamento indotto accelera il legame di AgTx2 di 400 volte. Così, è stato chiarito il meccanismo di AgTx2 per inibire efficacemente la funzione di KcsA (Figura 3).
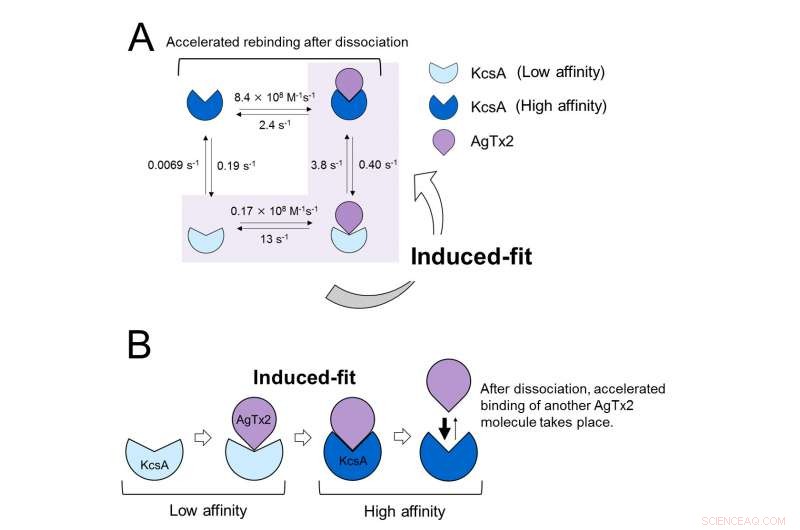
Modello della dinamica di legame di AgTx2 e canale del potassio KcsA. A. Costanti di velocità delle fasi di reazione. B. Legame accelerato di AgTx2 al canale del potassio KcsA attraverso un meccanismo di adattamento indotto. Credito:Università di Kanazawa
La tecnica e il metodo di osservazione HS-AFM utilizzati per l'analisi del legame del canale K+ e dell'inibitore peptidico possono essere applicati a un'ampia varietà di molecole biologiche. Possono essere applicati all'analisi di un ligando che si lega al suo recettore, nonché all'associazione del DNA e di una proteina che si lega al DNA. Questo studio dovrebbe accelerare la delucidazione delle dinamiche di legame di varie molecole biologiche.
Lo studio è pubblicato su Progressi scientifici .