
L'assistente professore del MIT Betar Gallant (a sinistra) e la studentessa laureata Aliza Khurram stanno sviluppando una nuova batteria che potrebbe sia catturare l'anidride carbonica negli scarichi della centrale elettrica sia convertirla in un solido pronto per lo smaltimento sicuro. Credito:Stuart Darsch
Riduzione dell'anidride carbonica (CO 2 ) le emissioni delle centrali elettriche sono ampiamente considerate una componente essenziale di qualsiasi piano di mitigazione del cambiamento climatico. Molti sforzi di ricerca si concentrano sullo sviluppo e l'implementazione di sistemi di cattura e sequestro del carbonio (CCS) per mantenere la CO 2 emissioni delle centrali elettriche in atmosfera. Ma separando la CO . catturata 2 e riconvertirlo in un gas che può essere immagazzinato può consumare fino al 25 percento della capacità di generazione di energia di un impianto. Inoltre, il CO 2 il gas viene generalmente iniettato in formazioni geologiche sotterranee per lo stoccaggio a lungo termine, un metodo di smaltimento la cui sicurezza e affidabilità rimangono non dimostrate.
Un approccio migliore sarebbe convertire la CO . catturata 2 in prodotti utili come combustibili o prodotti chimici a valore aggiunto. A quello scopo, l'attenzione si è concentrata sui processi elettrochimici, in questo caso, un processo in cui le reazioni chimiche rilasciano energia elettrica, come quando si scarica una batteria. Il mezzo ideale in cui condurre la conversione elettrochimica della CO 2 sembrerebbe acqua. L'acqua può fornire i protoni (particelle caricate positivamente) necessari per produrre combustibili come il metano. Ma l'esecuzione di tali sistemi "acquosi" (a base d'acqua) richiede grandi apporti energetici, e solo una piccola frazione dei prodotti formati sono tipicamente quelli di interesse.
Betar Galante, un assistente professore di ingegneria meccanica, e il suo gruppo al MIT si sono quindi concentrati su reazioni elettrochimiche non acquose (senza acqua), in particolare, quelli che si verificano all'interno del litio-CO 2 batterie.
Ricerca sul litio-CO 2 batterie è nelle sue primissime fasi, secondo Galant, ma l'interesse per loro sta crescendo perché CO 2 viene consumato nelle reazioni chimiche che si verificano su uno degli elettrodi mentre la batteria si scarica. Però, CO 2 non è molto reattivo I ricercatori hanno cercato di accelerare le cose utilizzando diversi elettroliti e materiali per elettrodi. Nonostante tali sforzi, è rimasta la necessità di utilizzare catalizzatori metallici costosi per suscitare attività elettrochimica.
Data la mancanza di progressi, Gallant voleva provare qualcosa di diverso. "Eravamo interessati a provare a portare una nuova chimica per affrontare il problema, " dice. E avvalendosi dell'aiuto delle molecole assorbenti che catturano così efficacemente la CO 2 in CCS sembrava una strada promettente da percorrere.
Ripensare l'ammina
La molecola assorbente utilizzata in CCS è un'ammina, un derivato dell'ammoniaca. In CCS, lo scarico viene fatto gorgogliare attraverso una soluzione contenente ammina, e l'ammina lega chimicamente la CO 2 , rimuovendolo dai gas di scarico. il CO 2 —ora in forma liquida—viene quindi separato dall'ammina e riconvertito in gas per lo smaltimento.

La studentessa laureata Aliza Khurram si prepara per gli esperimenti pompando anidride carbonica attraverso una cella elettrochimica composta da elettrodi di litio e carbonio più un elettrolita appositamente progettato. Credito:Stuart Darsch
In CCS, questi ultimi passaggi richiedono temperature elevate, che si ottengono utilizzando parte della potenza elettrica della centrale. Gallant si chiedeva se la sua squadra potesse invece utilizzare reazioni elettrochimiche per separare la CO 2 dall'ammina, quindi continuare la reazione per formare un solido, CO 2 -contenente prodotto. Se è così, il processo di smaltimento sarebbe più semplice di quello della CO . gassosa 2 . il CO 2 sarebbe più densamente imballato, quindi occuperebbe meno spazio, e non poteva scappare, quindi sarebbe più sicuro. Meglio ancora, energia elettrica aggiuntiva potrebbe essere estratta dal dispositivo mentre si scarica e forma il materiale solido. "La visione era quella di inserire un dispositivo simile a una batteria nel flusso di rifiuti della centrale elettrica per sequestrare la CO . catturata 2 in un solido stabile, raccogliendo l'energia rilasciata nel processo, "dice Galant.
La ricerca sulla tecnologia CCS ha generato una buona comprensione del processo di cattura del carbonio che avviene all'interno di un sistema CCS. Quando CO 2 viene aggiunto a una soluzione di ammina, molecole delle due specie si combinano spontaneamente per formare un "addotto, " una nuova specie chimica in cui le molecole originali rimangono in gran parte intatte. In questo caso, l'addotto si forma quando un atomo di carbonio in una CO 2 molecola si lega chimicamente con un atomo di azoto in una molecola di ammina. Mentre si combinano, il CO 2 la molecola viene riconfigurata:cambia dal suo originale, altamente stabile, forma lineare a una forma "piegata" con una carica negativa, una forma altamente reattiva pronta per ulteriori reazioni.
Nel suo schema, Gallant propose di usare l'elettrochimica per rompere la CO 2 -addotto amminico:proprio in corrispondenza del legame carbonio-azoto. Tagliare l'addotto in corrispondenza di quel legame separerebbe i due pezzi:l'ammina nel suo originale, stato non reagito, pronto a catturare più CO 2 , e il piegato, forma chimicamente reattiva della CO 2 , che potrebbe quindi reagire con gli elettroni e gli ioni di litio caricati positivamente che scorrono durante la scarica della batteria. L'esito di tale reazione potrebbe essere la formazione di carbonato di litio (Li 2 CO 3 ), che si depositerebbe sull'elettrodo di carbonio.
Allo stesso tempo, le reazioni sull'elettrodo di carbonio dovrebbero favorire il flusso di elettroni durante la scarica della batteria, anche senza un catalizzatore metallico. "La scarica della batteria avverrebbe spontaneamente, " Dice Gallant. "E romperemmo l'addotto in un modo che ci permetta di rinnovare la nostra CO 2 assorbitore durante l'assunzione di CO 2 ad una stalla, forma solida."
Un processo di scoperta
Nel 2016, La galante e dottoranda in ingegneria meccanica Aliza Khurram ha iniziato a esplorare questa idea.
La loro prima sfida è stata quella di sviluppare un nuovo elettrolita. Un litio-CO 2 la batteria è composta da due elettrodi, un anodo di litio e un catodo di carbonio, e un elettrolita, una soluzione che aiuta a trasportare le particelle cariche avanti e indietro tra gli elettrodi mentre la batteria viene caricata e scaricata. Per il loro sistema, avevano bisogno di un elettrolita fatto di ammina più CO . catturata 2 disciolto in un solvente e aveva bisogno di promuovere reazioni chimiche sul catodo di carbonio quando la batteria si scaricava.
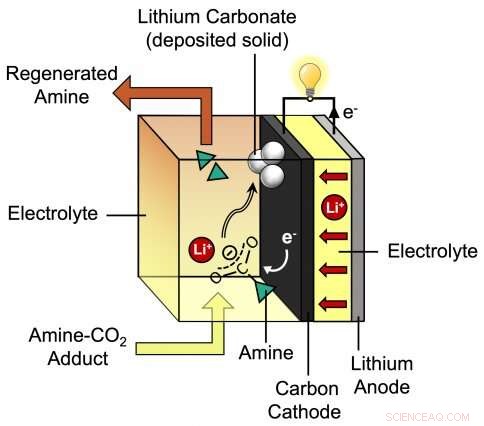
Questo diagramma mostra il processo durante la scarica della nuova batteria al litio-CO2 sviluppata dall'assistente professore del MIT Betar Gallant e dal suo gruppo. La batteria proposta dai ricercatori è costituita da un anodo di litio più un catodo di carbonio circondato da uno speciale elettrolita che incorpora ioni di litio (Li+) e ammina. Credito:Massachusetts Institute of Technology
Hanno iniziato testando possibili solventi. Hanno mescolato la loro CO 2 -assorbendo l'ammina con una serie di solventi frequentemente usati nelle batterie e poi facendo gorgogliare CO 2 attraverso la soluzione risultante per vedere se CO 2 potrebbe essere dissolto ad alte concentrazioni in questo ambiente chimico non convenzionale. Nessuna delle soluzioni ammina-solvente ha mostrato cambiamenti osservabili quando la CO 2 è stato presentato, suggerendo che potrebbero essere tutti validi candidati solvibili.
Però, per far funzionare qualsiasi dispositivo elettrochimico, l'elettrolita deve essere addizionato con un sale per fornire ioni caricati positivamente. Perché è una batteria al litio, i ricercatori hanno iniziato aggiungendo un sale a base di litio e i risultati sperimentali sono cambiati drasticamente. Con la maggior parte dei candidati solventi, l'aggiunta istantanea del sale faceva sì che la miscela formasse precipitati solidi o diventasse altamente viscoso, risultati che li escludevano come solventi vitali. L'unica eccezione era il solvente dimetilsolfossido, o DMSO. Anche quando era presente il sale di litio, il DMSO potrebbe sciogliere l'ammina e la CO 2 .
"Abbiamo scoperto che, casualmente, il sale a base di litio era importante per consentire alla reazione di procedere, " dice Gallant. "C'è qualcosa nello ione di litio caricato positivamente che si coordina chimicamente con l'ammina-CO 2 addotto, e insieme queste specie formano le specie elettrochimicamente reattive."
Esplorazione del comportamento della batteria durante la scarica
Per esaminare il comportamento di scarico del loro sistema, i ricercatori hanno allestito una cella elettrochimica costituita da un anodo di litio, un catodo di carbonio, e il loro elettrolita speciale, per semplicità, già carico di CO 2 . Hanno quindi monitorato il comportamento della scarica al catodo di carbonio.
Come avevano sperato, il loro elettrolita speciale ha effettivamente promosso la reazione di scarica nella cella di prova. "Con l'ammina incorporata nell'elettrolita a base di DMSO insieme al sale di litio e alla CO 2 , vediamo capacità molto elevate e tensioni di scarica significative, quasi tre volt, " dice Gallant. Sulla base di questi risultati, hanno concluso che il loro sistema funziona come un litio-CO 2 batteria con capacità e tensioni di scarica competitive con quelle delle batterie Litio-Gas di ultima generazione.
Il passo successivo è stato confermare che le reazioni stavano effettivamente separando l'ammina dalla CO 2 e continuando ulteriormente la reazione per produrre CO 2 -prodotti derivati. Per scoprirlo, i ricercatori hanno utilizzato una varietà di strumenti per esaminare i prodotti che si sono formati sul catodo di carbonio.

Questa immagine al microscopio elettronico a scansione (SEM) mostra il catodo dal sistema litio-anidride carbonica dei ricercatori dopo la scarica. L'analisi delle strutture sferiche conferma che sono composte da Li2CO3. L'inserto mostra un'immagine SEM del catodo di carbonio prima della scarica. L'assenza delle sfere conferma che si sono formate durante la scarica. Credito:Massachusetts Institute of Technology
In una prova, hanno prodotto immagini della superficie del catodo post-reazione utilizzando un microscopio elettronico a scansione (SEM). Immediatamente evidenti erano formazioni sferiche con una dimensione caratteristica di 500 nanometri, distribuito regolarmente sulla superficie del catodo. Secondo Galant, la struttura sferica osservata del prodotto di scarica era simile alla forma di Li 2 CO 3 osservato in altre batterie a base di litio. Quelle sfere non erano evidenti nelle immagini SEM del catodo di carbonio "incontaminato" scattate prima che si verificassero le reazioni.
Altre analisi hanno confermato che il solido depositato sul catodo era Li 2 CO 3 . Includeva solo CO 2 -materiali derivati; non erano presenti molecole amminiche o prodotti da esse derivati. Presi insieme, questi dati forniscono una forte evidenza che la riduzione elettrochimica della CO 2 l'ammina caricata avviene attraverso la scissione selettiva del legame carbonio-azoto.
"Si può pensare che l'ammina accenda efficacemente la reattività della CO 2 , " dice Gallant. "Questo è eccitante perché l'ammina comunemente usata nella CO 2 la cattura può quindi svolgere due funzioni critiche. Può fungere da assorbitore, recupero spontaneo di CO 2 dai gas di combustione e incorporandolo nella soluzione elettrolitica. E può attivare la CO 2 per ulteriori reazioni che non sarebbero possibili se l'ammina non ci fosse."
Direzioni future
Gallant sottolinea che il lavoro fino ad oggi rappresenta solo uno studio proof-of-concept. "C'è ancora molta scienza fondamentale da capire, " lei dice, prima che i ricercatori possano ottimizzare il loro sistema.
Lei e il suo team stanno continuando a indagare sulle reazioni chimiche che avvengono nell'elettrolita e sulla composizione chimica dell'addotto che si forma, lo "stato reagente" su cui viene eseguita la successiva elettrochimica. Stanno anche esaminando il ruolo dettagliato della composizione del sale.
Inoltre, ci sono preoccupazioni pratiche da considerare mentre pensano al design del dispositivo. Un problema persistente è che il deposito solido intasa rapidamente il catodo di carbonio, quindi non possono verificarsi ulteriori reazioni chimiche. In una configurazione stanno studiando, un design di batteria ricaricabile, il catodo viene scoperto durante ogni ciclo di scarica-carica. Le reazioni durante lo scarico depositano il solido Li 2 CO 3 , e le reazioni durante la carica lo sollevano, mettendo gli ioni di litio e CO 2 di nuovo nell'elettrolita, pronto a reagire e generare più elettricità. Però, la CO . catturata 2 torna quindi nella sua forma gassosa originale nell'elettrolita. Sigillare la batteria bloccherebbe quella CO 2 dentro, lontano dall'atmosfera, ma solo così tanto CO 2 può essere immagazzinato in una data batteria, quindi l'impatto complessivo dell'uso delle batterie per catturare la CO 2 le emissioni sarebbero limitate in questo scenario.

I ricercatori usano questa configurazione per testare la capacità di stoccaggio e la tensione di scarica delle loro batterie. Credito:Stuart Darsch
La seconda configurazione che i ricercatori stanno studiando, una configurazione di sola scarica, affronta questo problema non consentendo mai la CO gassosa 2 da riformare. "Siamo ingegneri meccanici, quindi ciò che ci interessa davvero è sviluppare un processo industriale in cui puoi in qualche modo raccogliere meccanicamente o chimicamente il solido mentre si forma, " Dice Gallant. "Immagina se con una vibrazione meccanica potessi rimuovere delicatamente il solido dal catodo, mantenendolo libero per una reazione prolungata." Collocato all'interno di un flusso di scarico, un tale sistema potrebbe rimuovere continuamente la CO 2 emissioni, generando elettricità e magari producendo allo stesso tempo materiali solidi di valore.
Gallant e il suo team stanno ora lavorando su entrambe le configurazioni del loro sistema. "Non sappiamo ancora quale sia meglio per le applicazioni, " dice. Mentre crede che pratico il litio-CO 2 le batterie sono ancora lontane anni, è eccitata dai primi risultati, che suggeriscono che lo sviluppo di nuovi elettroliti per pre-attivare la CO 2 potrebbe portare a CO . alternativa 2 vie di reazione. E lei e il suo gruppo stanno già lavorando su alcuni.
Un obiettivo è sostituire il litio con un metallo meno costoso e più ricco di terra, come sodio o calcio. Con il finanziamento iniziale della MIT Energy Initiative, la squadra ha già iniziato a studiare un sistema basato sul calcio, un materiale che non è ancora ben sviluppato per le applicazioni delle batterie. Se il calcio-CO 2 l'installazione funziona come previsto, il solido che si formerebbe sarebbe il carbonato di calcio, un tipo di roccia ora ampiamente utilizzato nell'industria delle costruzioni.
Intanto, Gallant e i suoi colleghi sono lieti di aver trovato quella che sembra essere una nuova classe di reazioni per catturare e sequestrare CO 2 . "CO 2 la conversione è stata ampiamente studiata per molti decenni, " lei dice, "quindi siamo entusiasti di pensare che potremmo aver trovato qualcosa di diverso e che ci offre una nuova finestra per esplorare questo argomento".
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.