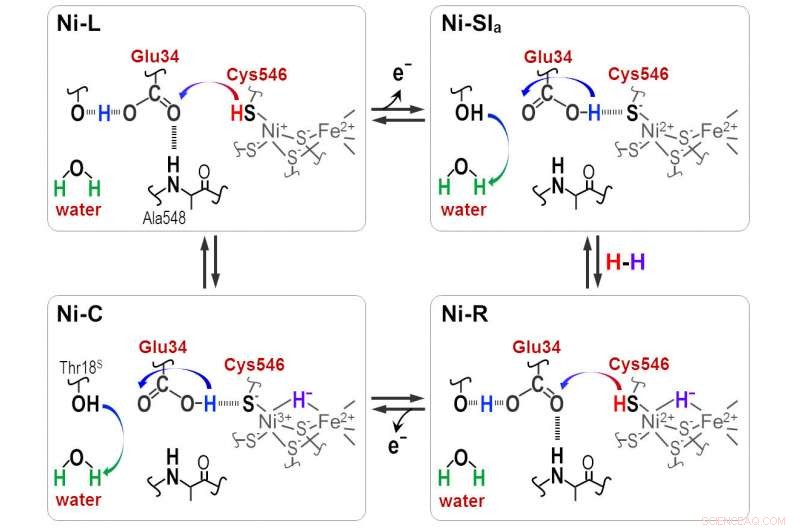
I protoni vengono trasferiti tra il sito attivo NiFe e la proteina circostante attraverso i residui Cyt546 e Glu34 durante la reazione catalitica dell'idrogenasi [NiFe]. Credito:Shun Hirota
Per tutti i progressi che la tecnologia ha fatto nel corso della nostra vita, in molti casi sta dietro a ciò che la natura può fare. Le formiche possono portare 5000 volte il loro peso, e le ragnatele sono cinque volte più resistenti dell'acciaio. L'efficienza del carburante non è diversa. In un nuovo stallone in Angewandte Chemie Edizione Internazionale , ricercatori del Nara Institute of Science and Technology (NAIST) riportano nuovi dettagli sulla via di trasferimento protonico della nichel-ferro [NiFe]-idrogenasi utilizzando la spettroscopia infrarossa a trasformata di Fourier (FTIR). Questo trasferimento è fondamentale per il metabolismo dell'idrogeno dei microrganismi, e lo studio offre agli scienziati una migliore comprensione di come imitare la natura nella costruzione di nuove celle a biocombustibile.
Il metabolismo dell'idrogeno è una delle forme più antiche di produzione di energia per la vita e una delle più studiate per il suo significato nell'evoluzione. Ha anche attirato l'attenzione in quanto fonte di energia pulita. Tra gli enzimi responsabili del metabolismo dell'idrogeno, La [NiFe]-idrogenasi è la più abbondante e antica.
Si sa molto sull'enzima. Ossida reversibilmente gli atomi di idrogeno attraverso il suo sito attivo Ni-Fe, che è circondato da amminoacidi specifici. Però, osserva il professor NAIST Shun Hirota, che ha gestito lo studio, alcuni fondamenti nelle reazioni chimiche devono essere compresi prima di utilizzare questa nanomacchina per progettare tecnologie di biocarburanti.
"Idruro e protone si coordinano con il sito Ni-Fe nel ciclo di protonazione-deprotonazione, risultando in quattro stati di idrogenasi. Ma il percorso di trasferimento del protone rimane sconosciuto, " lui dice.
Una ragione per la mancanza di chiarezza è stata l'incapacità di risolvere le frequenze di stiramento di diversi legami idrogeno. Nel nuovo lavoro, La squadra di Hirota, in collaborazione con altri ricercatori in Giappone e Cina, risolto questo problema osservando le fotoconversioni di tre stati di idrogenasi con spettri FTIR.
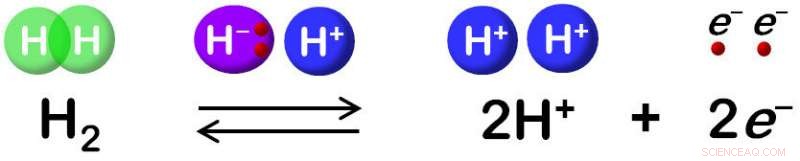
L'idrogenasi catalizza l'ossidazione reversibile di H2. Credito:Shun Hirota
Frequenze di assorbimento distinte hanno rivelato che una delle quattro cisteine, cisteina 546, insieme ad un altro amminoacido, acido glutammico 34, e una molecola d'acqua ordinata sono cruciali per il trasferimento. Gli scienziati hanno utilizzato le nuove informazioni per dedurre come la molecola di zolfo della cisteina 546 e il gruppo acido nell'acido glutammico 34 formano legami idrogeno per regolare il trasporto dell'idrogeno.
"I nostri risultati mostrano che la cisteina 546 è un donatore e accettore di protoni nel ciclo dell'idrogenasi [Ni-Fe]. Dimostrano anche come si forma e si scinde un legame idrogeno a bassa barriera per l'acido glutammico 34 durante il ciclo catalitico, " nota Hirota.
I microrganismi si sono adattati a una gamma di condizioni ambientali più ampia rispetto agli esseri umani. Si trovano nel clima confortevole delle nostre camere da letto agli ambienti più ostili della terra. Così, vedere come il sito [Ni-Fe] dell'idrogenasi [Ni-Fe] trasferisce protoni in modo ottimale fornisce un paradigma per i ricercatori che cercano di produrre catalizzatori energetici ad alta efficienza in una serie di condizioni.
"La vita ha passato miliardi di anni ad adattarsi all'energia. Crediamo che ci dia il miglior modello per l'efficienza energetica in futuro, "dice Hirota.