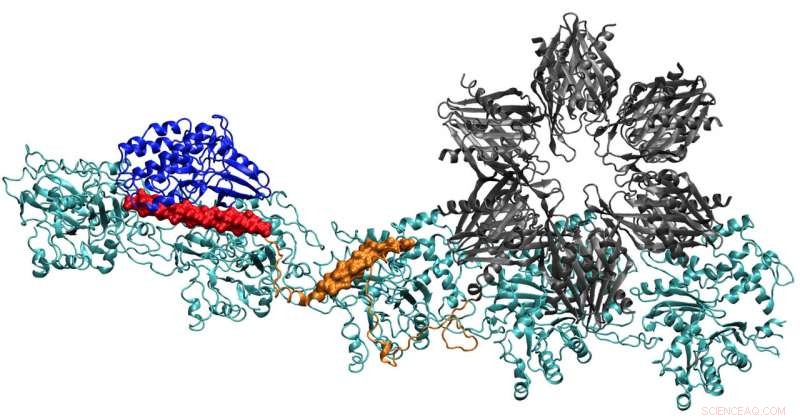
Un modello della proteina CaMKII mostra più domini che le consentono di legare i filamenti di actina nei dendriti dei neuroni in fasci, dando ai dendriti la loro forma. Ricercatori della Rice University, l'Università di Houston e l'Università del Texas Health Science Center di Houston ritengono che il complesso sia fondamentale nella formazione della memoria a lungo termine. Credito:Wolynes Research Lab/Rice University
Un nuovo pezzo di un puzzle difficile, la natura della memoria, è andato al suo posto questa settimana con un suggerimento su come le cellule cerebrali cambiano struttura quando imparano qualcosa.
Interazioni tra tre parti mobili:una proteina legante, una proteina strutturale e calcio, fanno parte del processo mediante il quale i segnali elettrici entrano nelle cellule neurali e rimodellano le strutture molecolari pensate per consentire la cognizione e l'immagazzinamento dei ricordi.
Colleghi della Rice University, l'Università di Houston (UH) e l'Università del Texas Health Science Center di Houston (UTHealth) hanno combinato teorie, simulazioni ed esperimenti per determinare come una proteina legante centrale, calcio-calmodulina-dipendente chinasi II (CaMKII), si lega e si separa dal citoscheletro di un neurone.
Il rapporto della squadra in Atti dell'Accademia Nazionale delle Scienze fornisce i primi chiari dettagli su come i siti di legame di CaMKII agiscono per allineare i filamenti di actina, la proteina strutturale, in lunghi, fasci rigidi. I fasci fungono da scheletri di supporto delle spine dendritiche, sporgenze appuntite che ricevono messaggi chimici attraverso sinapsi da altri neuroni.
Peter Wolynes, un fisico teorico alla Rice, si è unito a una collaborazione in corso tra il fisico UH Margaret Cheung e il neurobiologo UTHealth Neal Waxham che mirava a capire come i segnali si fanno strada attraverso i dendriti, i rami sulle cellule nervose che trasmettono informazioni tra le cellule.
Trovare la struttura completa di CaMKII si è dimostrato troppo complesso per la cristallografia a raggi X, sebbene si conoscessero parti della sua struttura. Quando combinato con l'actina che costituisce il citoscheletro, il sistema è diventato anche la più grande proteina che Wolynes e il suo team hanno analizzato tramite il loro programma di previsione della struttura proteica, AWSEM.
Quando ebbero finito, la struttura prevista dal computer era una notevole corrispondenza per le immagini bidimensionali del microscopio elettronico di Waxham e del suo gruppo che mostrano chiaramente che i filamenti di actina paralleli sono tenuti insieme, simile a una scala, dai pioli di CaMKII.
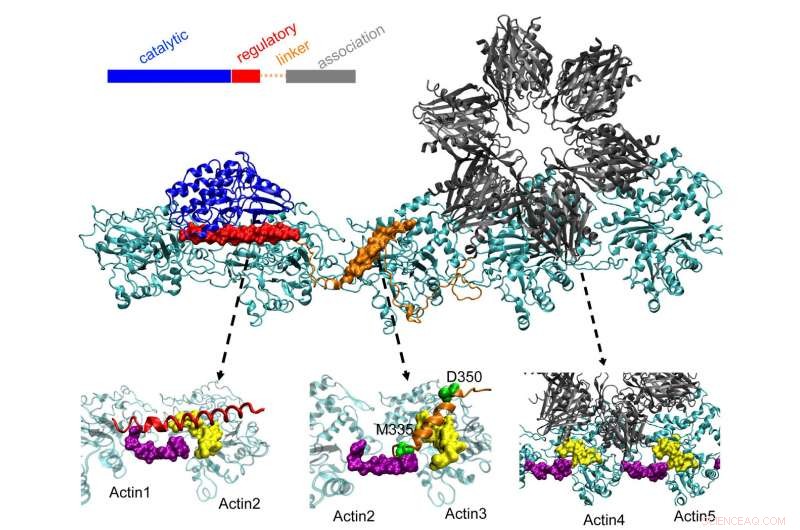
La proteina CaMKII in alto si aggancia in tre tasche su filamenti di actina attorcigliati nei neuroni, un processo che i ricercatori della Rice University, l'Università di Houston e l'Università del Texas Health Science Center di Houston (UTHealth) ritengono che sia importante per formare la memoria a lungo termine. Il dominio regolatorio (rosso) su CaMKII si lega anche alle proteine della calmodulina in entrata, che decomprime l'intera struttura dall'actina e consente ai filamenti in bundle di riorganizzarsi. Credito:Wolynes Research Lab/Rice University
"Ci sono sicuramente passaggi chimici preliminari che coinvolgono l'attività enzimatica di CaMKII prima di arrivare a questa fase; quindi, non abbiamo un'immagine completamente chiara di come mettere tutto insieme, "Ha detto Wolynes. "Ma è chiaro che l'assemblaggio del complesso è il passaggio chiave in cui la chimica si trasforma in una struttura su larga scala che può contenere un ricordo".
CaMKII è particolarmente adatto per interagire con l'actina, la proteina più abbondante nelle cellule eucariotiche e quella che ha abilità speciali nei neuroni, dove non solo deve dare a migliaia di dendriti (in ciascuno di miliardi di neuroni) le loro forme a riposo, ma deve anche dare loro un livello di plasticità per adattarsi a una raffica costante di segnali.
Le molecole di actina si autoassemblano in lunghe, filamenti di torsione. Le tasche idrofobiche tra queste molecole sono perfettamente configurate per legare CaMKII, una grande proteina con più parti, o domini. Questi domini si agganciano a tre siti di legame consecutivi sul filamento, e le torsioni mettono i siti di legame a intervalli regolari per evitare che le proteine si accumulino.
Il dominio di "associazione" di CaMKII è una subunità di sei volte che si lega anche ai filamenti adiacenti per formare fasci di actina, le spine dorsali delle spine dendritiche che danno a queste sporgenze la loro forma.
Questi fasci rimangono rigidi se il dendrite contiene poco calcio. Ma quando gli ioni calcio entrano attraverso la sinapsi, si combinano con le proteine della calmodulina, permettendo loro di legarsi a un'altra parte di CaMKII, il dominio regolatorio del floppy. Ciò innesca la dissociazione di un dominio di CaMKII dal filamento, seguito dal resto della proteina, aprendo una breve finestra di tempo durante la quale i bundle possono riconfigurarsi.
"Quando entra abbastanza calcio, la calmodulina attivata rompe queste strutture, ma solo per un po', "Ha detto Wolynes. "Allora il citoscheletro si riforma. Durante quel periodo, la spina dendritica può assumere una forma diversa che potrebbe essere più grande."
"Sappiamo che il calcio porta informazioni nella cellula, " Ha aggiunto Cheung. "Ma il modo in cui le cellule nervose sanno cosa farne dipende in realtà da come questa proteina codifica le informazioni. Una parte del nostro lavoro è connettere questo a livello molecolare e quindi proiettare come queste semplici regole geometriche sviluppano strutture su microscala più grandi".

Un'immagine al microscopio elettronico mostra filamenti di actina tenuti insieme in disposizioni parallele o ramificate da proteine CaMKII in un neurone. Simulazioni ed esperimenti effettuati presso la Rice University, l'Università di Houston e l'Università del Texas Health Science Center di Houston hanno mostrato che la distanza tra le particelle CaMKII adiacenti nei complessi è quasi fissata a 36 nanometri. La barra della scala è di 100 nanometri. L'immagine è stata realizzata nel Centro di imaging di biologia strutturale presso la McGovern Medical School dell'UTHealth. Credito:Waxham Lab/UTHealth
I calcoli del team hanno mostrato che il dominio di associazione è responsabile di circa il 40% della forza di legame della proteina all'actina. Un dominio linker aggiunge un altro 40% e il dominio normativo cruciale fornisce l'ultimo 20%:una strategia sensata, poiché il dominio regolatore è alla ricerca di calcio-calmoduline in entrata che possono decomprimere l'intera proteina dal filamento.
Il progetto è stato realizzato attraverso il Centro di Fisica Teorica Biologica (CTBP) di Rice, di cui Wolynes è co-direttore e Cheung uno scienziato senior. La loro associazione risale a quando entrambi erano all'Università della California, San Diego, lui come professore e lei come studente laureato del fisico del riso José Onuchic, anche un co-direttore CTBP. Wolynes ha anche fatto parte del suo pannello di revisione della tesi, lei disse.
Cheung era a conoscenza del lavoro precedente di Wolynes e del suo gruppo Rice che suggeriva che l'actina stabilizza le fibre simili a prioni che si pensa codificassero i ricordi nei neuroni e ha deciso che era una buona partita per la sua ricerca con Waxham per vedere come il calcio attiva CaMKII.
"Questo è uno dei problemi più interessanti delle neuroscienze:come i cambiamenti chimici a breve termine portano a qualcosa di lungo termine, come la memoria?" ha detto Waxham. "Penso che uno dei contributi più interessanti che diamo sia quello di catturare come il sistema prende i cambiamenti che avvengono in millisecondi in secondi e costruisce qualcosa che può sopravvivere al segnale iniziale".
Il puzzle è lungi dall'essere completo, ha detto Wolynes. "Il lavoro precedente di Margaret e Neal riguardava l'inizio di eventi della memoria, " ha detto dello studio dei suoi colleghi sulla calmodulina. "Il nostro articolo sui prioni riguardava la conservazione della memoria, alla fine del processo di apprendimento. E recitare è nel mezzo. Potrebbero esserci molte altre cose nel mezzo, pure.
"Queste domande generali sono interessanti per molte persone, " ha detto. "Questo è un elemento chiave del problema, ma chiaramente non è la fine della storia".