Credito:McGill University
I ricercatori della Facoltà di Medicina della McGill University hanno compiuto importanti passi avanti nella comprensione del funzionamento degli enzimi che svolgono un ruolo fondamentale nella produzione di antibiotici e altre terapie. I loro risultati sono pubblicati in Scienza .
"Molti dei farmaci su cui ci affidiamo oggi sono prodotti naturali, fatto dalla flora terrestre, " spiega il dottor Martin Schmeing, Professore Associato presso il Dipartimento di Biochimica della McGill e autore senior dello studio. "Questo include composti prodotti nei microbi da enzimi massicci chiamati sintetasi peptidiche non ribosomiali, o NRPS. Gli NRPS sintetizzano tutti i tipi di antibiotici, che possono uccidere funghi e batteri pericolosi, così come composti per aiutarci a combattere le infezioni virali e i tumori. Per esempio, questi composti includono viomicina, un antibiotico utilizzato per il trattamento della tubercolosi multiresistente; ciclosporina, che è stato ampiamente utilizzato come immunosoppressore nei trapianti di organi; e la familiare penicillina antibiotica."
Per sintetizzare questi farmaci, Gli NRPS funzionano in modo simile a una catena di montaggio in fabbrica, costituito da una serie di postazioni di lavoro. Ogni stazione, chiamato "modulo, " ha flussi di lavoro in più fasi e parti mobili che gli consentono di aggiungere un componente costitutivo al farmaco in crescita.
Comprendere il funzionamento interno della catena di montaggio
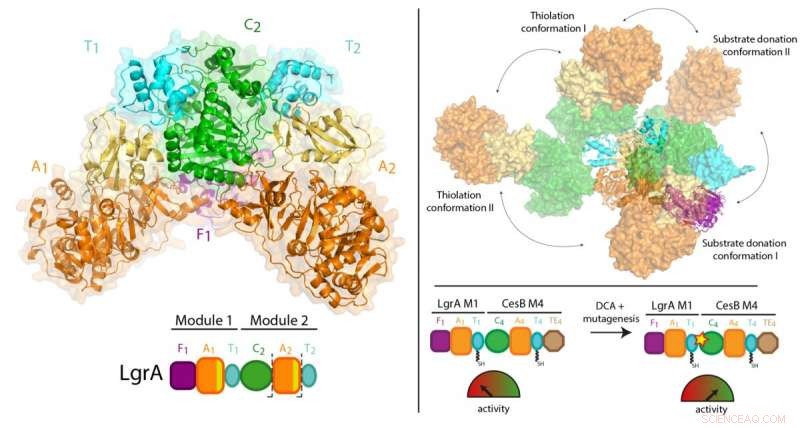
Il lavoro precedente del Dr. Schmeing e altri ha portato a una solida comprensione di come funziona un modulo. Ora, utilizzando una tecnica chiamata cristallografia a raggi X presso la Canadian Light Source in Saskatchewan, e l'Advanced Photon Source in Illinois, il team è stato in grado di scattare foto 3D ad altissima risoluzione degli NRPS.
Per la prima volta, sono stati in grado di fare osservazioni di alta qualità su come un singolo modulo si relaziona alla catena di montaggio più grande, visualizzando una porzione a due moduli degli NRPS che rende l'antibiotico gramicidina lineare (presente nei trattamenti con polisporina). Lo studio ha riscontrato una sorprendente mancanza di sincronizzazione tra i moduli in tutti i punti tranne quando devono coordinarsi per passare l'intermedio da una postazione di lavoro all'altra. Inoltre, hanno scoperto che i moduli non si allineano in linea retta o in un altro modo organizzato, ma invece può allinearsi in molte posizioni relative differenti. "Questo livello di enorme flessibilità non era previsto, " nota il dottor Schmeing, che è anche direttore del Centro di biologia strutturale McGill. "Gli enzimi stanno facendo ginnastica."
Poiché le proteine sono intrappolate in un cristallo, è stata prestata attenzione per confermare che i risultati fossero rappresentativi di ciò che accade nella vita reale. Il dottor Schmeing ha lavorato con il suo collega, Dott.ssa Alba Guarne, Professore nel Dipartimento di Biochimica della McGill, utilizzare dati di soluzioni complementari, raccolti presso l'Advanced Light Source di Berkeley per convalidare le osservazioni. "La comunità della biologia strutturale è molto forte alla McGill. Lavoriamo insieme per aiutarci a vicenda in collaborazioni, per ottenere l'attrezzatura biofisica necessaria per esperimenti all'avanguardia, e per formare i nostri studenti", afferma il dott. Schmeing, notando che gli sperimentalisti sulla carta, Janice Reimer, Max Eivaskhani e Ingrid Harb, sono tutti studenti laureati McGill di talento. "L'ambiente e i colleghi del McGill Center for Structural Biology sono importanti per il continuo successo dei nostri laboratori".
Implicazioni future per il design terapeutico
I risultati potrebbero avere implicazioni per la produzione di nuovi antibiotici e terapie a lungo termine. Da quando sono stati scoperti, gli scienziati sono stati entusiasti della possibilità di bioingegneria NRPS mescolando e abbinando stazioni di lavoro per produrre composti di design. "Il nostro studio mostra che dovrebbe essere possibile combinare e abbinare questi moduli, ma che gli NRPS bioingegnerizzati devono essere modificati nei punti coinvolti nel passaggio del composto da un modulo all'altro per farli funzionare bene, " spiega il Dr. Schmeing. "Questo è qualcosa che abbiamo collaborato con Martin Weigt della Sorbona per farlo come prova di principio nel documento, ma che dovrà essere ottimizzato per la produzione di terapie di design".
"Le strutture di una sintetasi peptidica non ribosomiale dimodulare rivelano flessibilità conformazionale, " di Reimer, J.M., Eivaskhani, M, Harb, IO., Guarne, UN, peso, M., Schmeing, T. M. è stato pubblicato sulla rivista Scienza .