Modificazioni chimiche della sfera di coordinazione in Cu(II)-amiloide-β utilizzando la chimica del rame-O2. Attestazione:KAIST
È diventato evidente di recente che le interazioni tra rame e amiloide-β hanno un impatto neurotossico sul cervello dei pazienti con malattia di Alzheimer. I ricercatori KAIST hanno segnalato una nuova strategia per alterare la neurotossicità nella malattia di Alzheimer utilizzando un reagente chimico progettato razionalmente.
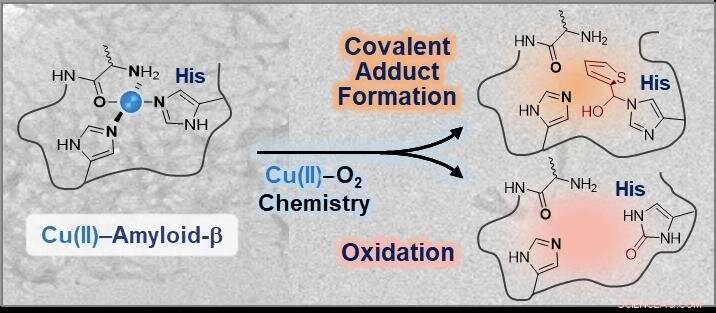
Questa strategia, sviluppato dal Professor Mi Hee Lim del Dipartimento di Chimica, può modificare la sfera di coordinazione del rame legato all'amiloide-β, inibendo efficacemente il legame del rame all'amiloide-β e alterandone l'aggregazione e la tossicità. Il loro studio è stato presentato in PNAS lo scorso mese.
I ricercatori hanno sviluppato una piccola molecola in grado di interagire direttamente con la sfera di coordinazione dei complessi rame-amiloide-β seguiti da modifiche tramite coniugazione covalente, ossidazione, o entrambi in condizioni aerobiche. Il team di ricerca ha semplicemente utilizzato la chimica del rame-diossigeno per progettare un reagente chimico.
Rispondere al modo in cui si verificano le modifiche del peptide da parte di una piccola molecola rimane molto impegnativo. Il sistema comprende metalli di transizione e proteine amiloidogeniche ed è abbastanza eterogeneo, poiché vengono continuamente modificati. È fondamentale controllare attentamente le molteplici variabili come la presenza di diossigeno e il tipo di ioni di metalli di transizione e proteine amiloidogeniche al fine di identificare i meccanismi sottostanti e la specificità target del reagente chimico.
Il team di ricerca ha impiegato vari metodi biofisici e biochimici per determinare i meccanismi delle modifiche sulla sfera di coordinazione dei complessi rame-Aβ. Tra loro, le modifiche dei peptidi sono state principalmente analizzate mediante spettrometria di massa a ionizzazione elettrospray.
La spettrometria di massa (MS) è stata applicata per verificare tali modifiche del peptide calcolando lo spostamento nella massa esatta. Il team di ricerca ha anche eseguito la dissociazione indotta da collisione (CID) dello ione bersaglio rilevato dalla SM per individuare quale residuo di amminoacidi è stato specificamente modificato. Il CID frammenta il legame ammidico situato tra i residui di amminoacidi. Questa analisi frammentaria ci permette di identificare i siti specifici delle modificazioni peptidiche.

Il professor Lim (a sinistra) e il dottorando Han. Credito:The Korea Advanced Institute of Science and Technology (KAIST)
I complessi rame e amiloide-β rappresentano una connessione patologica tra ioni metallici e amiloide-β nella malattia di Alzheimer. Recenti scoperte indicano che il rame e l'amiloide-β possono contribuire direttamente alla neurodegenerazione producendo oligomeri tossici dell'amiloide-β e specie reattive dell'ossigeno.
Il professor Lim ha detto, "Questo studio illustra la prima prova sperimentale che il quattordicesimo residuo di istidina nei complessi rame-amiloide-β può essere specificamente modificato attraverso la coniugazione covalente, ossidazione, o entrambi. Considerando le implicazioni neurotossiche delle interazioni tra rame e amiloide-β, tali modifiche nella sfera di coordinazione del rame nell'amiloide-β potrebbero alterarne efficacemente le proprietà e la tossicità".
"Questo studio multidisciplinare con un'enfasi sugli approcci, reattività, e meccanismi non vedono l'ora di aprire un nuovo modo per sviluppare candidati di malattie anti-neurodegenerative, " ha aggiunto. La National Research Foundation of Korea ha finanziato questa ricerca.