Un'illustrazione delinea il ciclo NEET nelle cellule mediante il quale i cluster ferro-zolfo vengono consegnati da MiNT, proteine mitoNEET (mNT) e NAF-1 nel citosol o nei mitocondri (in basso) a una serie di processi metabolici cellulari, compresa la sintesi di ATP. Credito:Patricia Jennings/Università della California a San Diego
Una proteina a due facce in una catena che regola il ferro e altri elementi nelle cellule potrebbe fornire un nuovo obiettivo per curare il cancro, diabete e altre malattie.
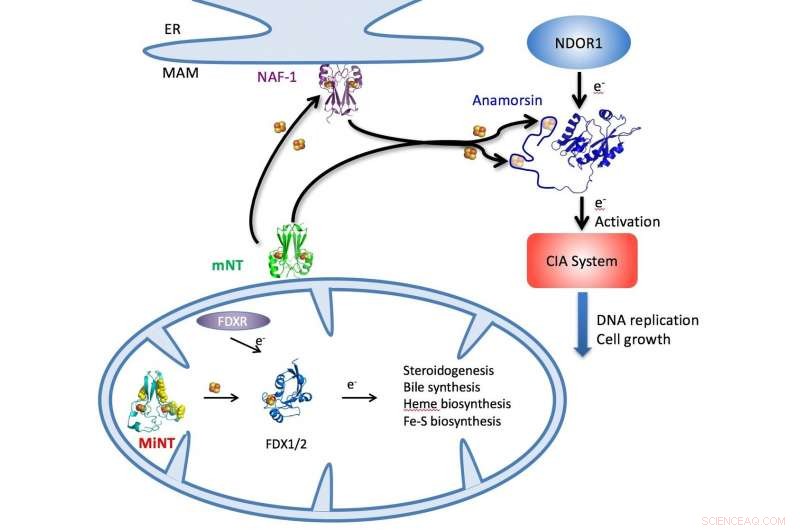
Un team di ricercatori della Rice University, l'Università della California a San Diego (UCSD), l'Università Ebraica di Gerusalemme e l'Università del Texas settentrionale hanno dettagliato la struttura di una proteina chiamata NEET interno mitocondriale (MiNT), parte di un percorso che stabilizza i mitocondri, gli organelli che producono energia per le cellule.
Il loro rapporto appare questa settimana nel Atti dell'Accademia Nazionale delle Scienze .
MiNT è distinto dai suoi cugini, le proteine NEET mitoNEET e NAF-1, ma tutti giocano un ruolo nella progressione del cancro, diabete, malattie neurodegenerative e invecchiamento. Le proteine NEET sono state al centro dell'attenzione del team che in precedenza aveva riportato la loro importanza nel legare gruppi tossici di ferro e zolfo nelle cellule e come possibile bersaglio per il trattamento del cancro al seno.
Nel nuovo studio, i ricercatori guidati dai collaboratori di lunga data Patricia Jennings della UCSD e José Onuchic del Rice's Center for Theoretical Biological Physics (CTBP) sono stati i primi a dettagliare la struttura cristallina di MiNT, noto anche come CISD3, che risiede all'interno dei mitocondri.
Jennings e il suo team hanno prodotto la struttura molecolare. Con esso, sono stati in grado di dimostrare che mentre MiNT condivide alcune caratteristiche con altre proteine ferro-zolfo della famiglia NEET, ci sono differenze significative che probabilmente lo rendono il più potente dei tre.
MitoNEET e NAF-1 (alias CISD1 e CISD2, rispettivamente) sono dimeri, proteine con due simili, monomeri connessi che risiedono nel citosol, il fluido all'interno delle cellule. Ma MiNT è un monomero che vive esclusivamente all'interno dei mitocondri, dove raccoglie i cluster ferro-zolfo forniti dagli altri NEET e li distribuisce per facilitare, tra l'altro, la sintesi di adenosina trifosfato (ATP), la molecola che trasporta energia attraverso le cellule per consentire i processi metabolici.
MiNT differisce anche mostrando due lati del suo ambiente, uno idrofobo (idrorepellente) e l'altro idrofilo (attraente l'acqua). "Perché è un monomero, ogni lato è diverso, quindi interagirà con diverse proteine, e potresti essere in grado di bersagliarlo con farmaci diversi su ciascun lato, " ha detto Jennings, un affiliato CTBP e un professore di chimica e biochimica alla UCSD.
"È più veloce ed efficiente degli altri NEET, " disse Onuchic, il cui laboratorio ha costruito simulazioni al computer per studiare le dinamiche di piegatura di MiNT. "Sarebbe molto pericoloso avere una proteina del genere nel citosol;
ecco perché è limitato all'interno dei mitocondri, dove avvengono molti processi bioenergetici."
I ricercatori hanno affermato che la menta è essenziale per l'equilibrio del ferro e delle specie reattive dell'ossigeno (ROS) nei mitocondri. "Il ferro è tossico, " Jennings ha detto. "Troppo di esso nella cella è male. Dobbiamo quindi controllarlo nei nostri corpi perché è così importante per la regolazione dell'energia e la chiave per la salute e le malattie.
"Con la struttura di MiNT, possiamo iniziare a capire il ciclo regolatorio completo che controlla i cluster ferro-zolfo e i ROS che non erano stati riconosciuti prima, " ha detto. "Possiamo iniziare a vedere come queste proteine regolano il flusso dentro e fuori i mitocondri".
Il ruolo di MiNT nella produzione di ATP può renderlo un bersaglio efficace per ridurre i tumori, disse Onuchic. Precedenti esperimenti con gli altri NEET hanno mostrato che la sottoregolazione della loro espressione o il targeting dei loro centri riducono la quantità di energia disponibile per le cellule tumorali, che riduce la crescita del tumore.
"Le cellule tumorali hanno bisogno di molto più ferro rispetto alle cellule sane con la normale omeostasi del ferro, " disse. "Quando una cellula si divide, deve raddoppiare i ribosomi, e questo è energeticamente molto costoso. Poiché le cellule tumorali si dividono così rapidamente, hanno bisogno di molto più ferro e dipendono dal ciclo NEET per fornirlo.
"Il cancro usa le tre proteine NEET perché richiedono così tanto ferro e ossigeno reattivo, " Disse Onuchic. "Quello che abbiamo notato, anche se non è chiaro esattamente come funzionino, è che se ne abbatti qualcuno, fa rimpicciolire i tumori. Anche se ne abbatti solo uno, riduce la crescita del cancro." Poiché MiNT è un produttore più prodigioso di ferro e ROS, potrebbe essere il più efficace dei tre da mirare, Egli ha detto.
"La scoperta della struttura MiNT, la dinamica e il coinvolgimento nel ferro mitocondriale e nell'accumulo di ROS hanno consentito la caratterizzazione dell'intera famiglia di proteine umane NEET, " ha detto la co-autrice Rachel Nechushtai, professore all'Università Ebraica di Gerusalemme. "Inoltre, fornisce al nostro team internazionale l'opportunità unica di svelare le interrelazioni delle tre proteine NEET e di scoprire in quali percorsi cellulari sono coinvolte.
"La scoperta che tutte e tre le proteine ferro-zolfo cooperano nello stesso percorso per proteggere le cellule tumorali fornisce un eccellente insieme di bersagli per la terapia del cancro, " lei disse.
"Il legame che le proteine NEET forniscono tra i livelli di ferro nelle cellule tumorali e il livello delle specie reattive dell'ossigeno dimostra come le cellule tumorali controllino l'equilibrio tra un alto tasso di proliferazione e mutazioni, che è la chiave per la nostra comprensione di come combattere il cancro, " ha detto il co-autore Ron Mittler, un professore di scienze biologiche presso l'Università del North Texas.