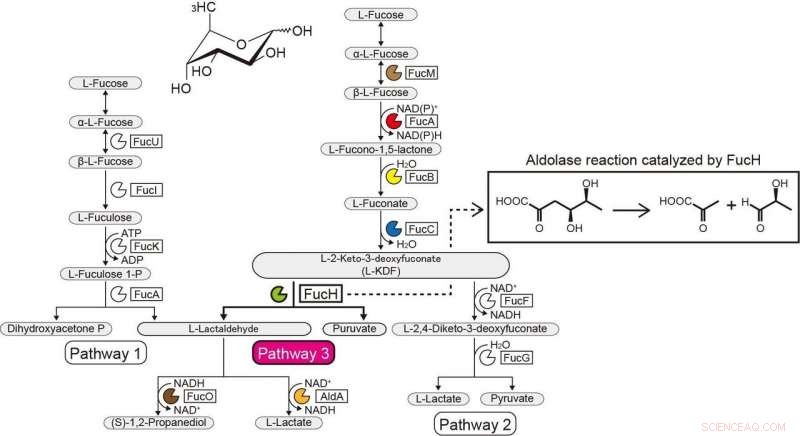
Vie metaboliche del L-Fucosio. Credito:Ehime University
Il contesto genetico nei genomi batterici e lo screening di potenziali substrati possono aiutare a identificare le funzioni biochimiche degli enzimi batterici. Il Gram-negativo, il batterio strettamente anaerobico Veillonella ratti possiede un cluster di geni che sembra essere correlato al metabolismo dell'L-fucosio e contiene una proteina putativa diidrodipicolinato sintasi DHDPS/NAL (FucH). Qui, lo screening di una libreria di acidi 2-cheto-3-deossizucchero con questa proteina e la caratterizzazione biochimica dei geni vicini ha rivelato che questo cluster di geni codifica per enzimi in una via di L-fucosio non fosforilante "Route I" precedentemente sconosciuta.
Precedenti studi su altre aldolasi nella superfamiglia delle proteine DHDPS/NAL hanno utilizzato solo un numero limitato di composti, e l'approccio qui riportato ha permesso di delucidare le specificità del substrato e le selettività stereochimiche di queste aldolasi e il loro confronto con quelli di FucH. Secondo la reazione di scissione aldolica, le aldolasi erano specifiche per i gruppi (R)- e (S)-stereospecifici nella posizione C4 dell'acido 2-cheto-3-deossizucchero, ma non aveva specificità strutturale o preferenza per i gruppi metilici nelle posizioni C5 e C6, rispettivamente.
Questa categorizzazione corrispondeva alla selettività (Re)- o (Si)-facciale della piruvato enammina sulla (glicer)aldeide carbonile nella reazione di condensazione aldolica. Queste proprietà sono comunemente determinate dal fatto che un residuo di serina o treonina sia posizionato nella posizione equivalente vicino al sito o ai siti attivi, e la mutagenesi sito-diretta ha notevolmente modificato la preferenza C4-OH e la formazione selettiva di un diastereomero. Proponiamo che la specificità del substrato delle aldolasi dell'acido 2-cheto-3-deossizucchero sia stata acquisita in modo convergente durante l'evoluzione e riportiamo la scoperta di un'altra aldolasi L-2-cheto-3-deossifuconato coinvolta nella stessa via L-fucosio non fosforilante in Campylobacter jejuni .
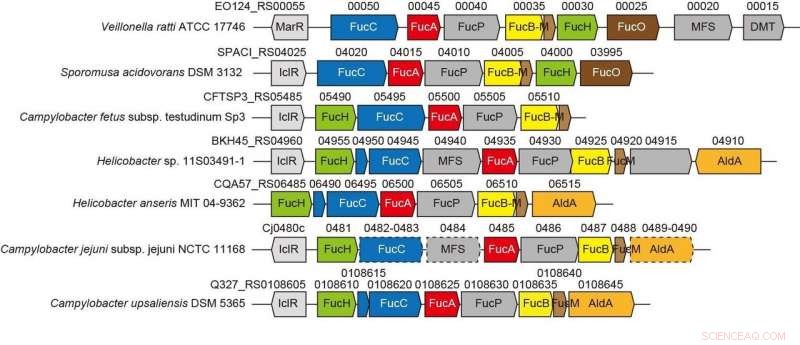
Cluster di geni correlati a una nuova via non fosforilativa dell'L-fucosio da batteri anaerobi e patogeni. Credito:Ehime University