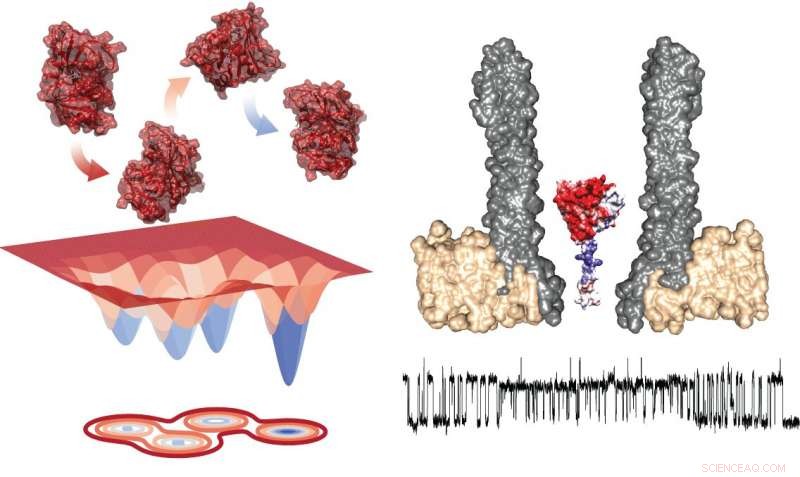
Diagramma energetico dei quattro conformeri (a sinistra) e il setup sperimentale che mostra il nanoporo con l'enzima intrappolato in sezione trasversale (a destra). Sotto, c'è una traccia tipica che mostra le misurazioni durante lo scambio all'interno dei rotameri. Crediti:Giovanni Maglia, Università di Groninga
Gli scienziati dell'Università di Groningen hanno osservato le caratteristiche di un singolo enzima all'interno di un nanoporo. Hanno appreso che l'enzima può esistere in quattro diversi stati ripiegati, o conformisti, che svolgono un ruolo attivo nel meccanismo di reazione. Questi risultati avranno conseguenze per l'ingegneria enzimatica e lo sviluppo di inibitori. Lo studio è stato pubblicato su Chimica della natura il 6 aprile.
Gli enzimi sono proteine piegate che hanno una struttura tridimensionale specifica che crea un sito attivo che può legare un substrato e catalizzare una reazione specifica. Negli ultimi anni, è diventato chiaro che gli enzimi non sono strutture rigide, ma che le proteine ripiegate esistono come un insieme di conformazioni in equilibrio attorno a uno stato fondamentale energeticamente stabile.
Galleria del vento
Lo studio della transizione tra gli stati richiede l'osservazione di singoli enzimi per un periodo di tempo prolungato, che è impegnativo. Il Professore Associato di Biologia Chimica dell'Università di Groningen, Giovanni Maglia, ha sviluppato nanopori a forma di imbuto in grado di intrappolare le proteine. Misurando la corrente ionica attraverso un tale nanoporo incorporato in una membrana lipidica artificiale, Maglia è stata in grado di osservare i cambiamenti conformazionali negli enzimi. "Potresti paragonarlo allo studio di un'auto in una galleria del vento, " spiega. "Aprire una finestra o una porta cambierà il flusso d'aria. In un modo simile, un cambiamento nella struttura di piegatura dell'enzima cambia la corrente ionica attraverso il poro."
Maglia ha utilizzato il suo sistema a nanopori per studiare l'enzima diidrofolato reduttasi (DHFR), che converte il diidrofolato in tetraidrofolato. "Abbiamo scelto questo enzima perché è stato studiato come sistema modello per la dinamica enzimatica per oltre 30 anni, utilizzando tutte le tecniche disponibili. Inoltre, inibitori di questo enzima, come il metotrexato, sono usati come farmaci antitumorali.
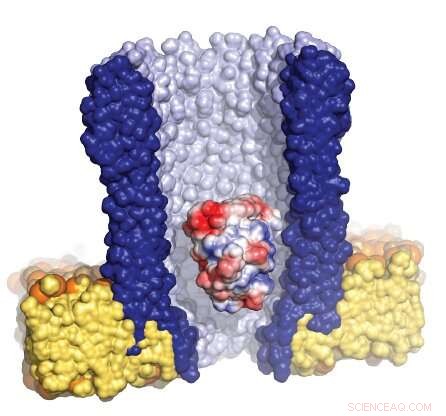
Illustrazione del nanoporo a forma di imbuto (blu) circondato dalla membrana artificiale (giallo), con un singolo enzima (rosso/bianco/blu) intrappolato all'interno del poro. Crediti:Giovanni Maglia, Università di Groninga
Rilascio efficiente
Le misurazioni del DHFR hanno rivelato la presenza di quattro conformeri con affinità diverse per i substrati. Maglia dice, "Il passaggio tra questi quattro stati è stato molto lento. Ciò significa che è possibile vederli solo in questo tipo di studi su singoli enzimi di lunga durata".
Aggiungendo l'inibitore della reazione metotrexato, che si lega all'enzima, ha causato una transizione molto rapida tra gli stati e ha modificato l'affinità degli enzimi. "La nostra conclusione è che le reazioni dell'enzima con diversi composti forniscono l'energia libera per i cambiamenti conformazionali, "dice Maglia.
Per di più, il cambiamento conformazionale ha anche modificato l'affinità degli enzimi. Questo ha senso, poiché l'enzima deve legare due substrati e, dopo aver completato la reazione, deve rilasciare entrambi. "Il substrato e il prodotto sono molecole molto simili, quindi l'enzima deve cambiare la sua affinità per un rilascio efficiente".
Due stati
Sulla base di questi studi, Maglia può vedere l'enzima passare da uno stato all'altro:dopo aver legato il substrato, NADPH guida la reazione, che poi cambia la conformazione dell'enzima e quindi la sua affinità. Successivamente, legare un nuovo substrato lo riporta al primo stato. "Questo spiega due dei quattro conformeri che abbiamo osservato; non possiamo ancora dare un senso agli altri due, “Dice Maglia. Dalle misurazioni è impossibile ricavare informazioni strutturali.
Tuttavia, lo studio mostra il potere della tecnologia dei nanopori nel determinare i cambiamenti strutturali degli enzimi. "Ora sappiamo anche che questo enzima ha quattro diversi stati fondamentali e deve passare da uno all'altro per funzionare". Ciò aggiunge una sfida alla progettazione degli enzimi:non solo questo dovrebbe produrre un centro reattivo, ma dovrebbe anche consentire i necessari cambiamenti conformazionali. Maglia:"Questo potrebbe spiegare perché gli enzimi progettati artificialmente spesso non funzionano in modo efficiente come gli enzimi naturali." Finalmente, lo studio consentirà inoltre agli scienziati di identificare nuovi farmaci inibitori che si legano più strettamente alla DHFR rispetto al metotrexato.