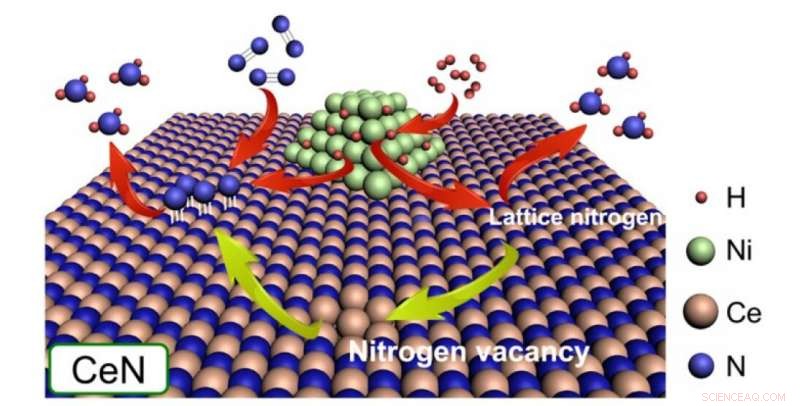
Le particelle di nichel dissociano H2 per fornire atomi di H agli atomi di N dal reticolo cristallino di CeN stesso o agli atomi di N sporgenti dalle molecole di N2 che riempiono un vuoto di azoto. In questo studio, è stato scoperto che CeN senza Ni può anche dissociare le molecole di H2. Credito:2020 American Chemical Society
Gli scienziati del Tokyo Institute of Technology (Tokyo Tech) esplorano come le vacanze di azoto nei catalizzatori partecipano alla sintesi dell'ammoniaca, una sostanza chimica fondamentale nell'industria dei fertilizzanti. Hanno ideato una regola generale per la progettazione intelligente di catalizzatori a base di nitruro in base alla loro energia di formazione del vuoto di azoto e hanno creato un catalizzatore ad alte prestazioni per la sintesi dell'ammoniaca utilizzando cerio, un abbondante metallo di transizione.
ammoniaca (NH 3 ) è una sostanza chimica presente in natura nell'ambiente, ma il suo uso diffuso come ingrediente importante in vari processi produttivi lo ha reso uno dei prodotti chimici più prodotti. È fondamentale nella produzione di fertilizzanti e aiuta ad aumentare la resa di varie colture. A causa della sua forte domanda, ben oltre 150 milioni di tonnellate di NH 3 vengono prodotti annualmente. Non sorprendentemente, i chimici sono attivamente alla ricerca di modi ecologici ed efficienti dal punto di vista energetico per sintetizzare NH 3 .
Il modo convenzionale per produrre NH 3 è utilizzando direttamente azoto (N 2 ) e idrogeno (H 2 ) gas. Ma, rompere il forte legame tra N atomi è impegnativo. È qui che entrano in gioco i catalizzatori (materiali che facilitano le reazioni necessarie). Sfortunatamente, il miglior catalizzatore di oggi per NH 3 la sintesi richiede rutenio, un metallo raro e costoso. Nel tentativo di trovare alternative, scienziati della Tokyo Tech, compreso il dottor Tian-Nan Ye, Prof Masaaki Kitano, e il professor Hideo Hosono, hanno recentemente cercato di scoprire esattamente cosa rende un buon catalizzatore per rompere N 2 e producendo NH 3 .
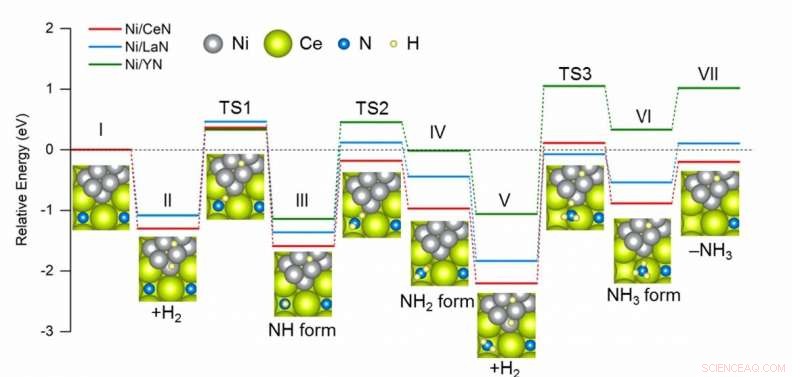
Diagramma comparativo dell'energia richiesta in ogni fase durante la sintesi di NH3 utilizzando diversi catalizzatori. Ni/CeN ha il profilo energetico più favorevole per la formazione di nuove vacanze di azoto, che si traduce in migliori prestazioni catalitiche. Credito:2020 American Chemical Society
In un precedente articolo pubblicato su Natura , Hosono e colleghi hanno presentato una nuova strategia per produrre NH 3 che prevedeva l'uso di nitruro di lantanio (LaN) accoppiato a nanoparticelle di nichel (Ni). Il contributo chiave di questo studio è stata la consapevolezza che le vacanze di azoto svolgono un ruolo importante nel processo catalitico, che ha permesso loro di progettare un catalizzatore a base di La con prestazioni paragonabili a quelle di quelli a base di rutenio. In un recente studio, pubblicato in Giornale della Società Chimica Americana , il team di ricerca ha ulteriormente approfondito le proprie scoperte ed ha esplorato se l'energia necessaria per produrre questi posti vacanti di azoto è ciò che in definitiva definisce le prestazioni dei catalizzatori durante l'NH 3 produzione.
Le vacanze di azoto sulla superficie del catalizzatore possono facilmente catturare N 2 e indebolire il suo legame N-N, dopo di che gli atomi si sono dissociati da H 2 alle nanoparticelle di Ni saltano sull'atomo di N sporgente per produrre NH 3 . Inoltre, atomi di H dissociati possono anche formare NH 3 utilizzando direttamente atomi di N dal reticolo cristallino del catalizzatore stesso, creando così nuovi posti vacanti di azoto nel processo. Dopo il successo del loro precedente catalizzatore Ni/LaN, in questo studio, hanno creato e confrontato catalizzatori simili con differenti energie di formazione di vacanze di azoto (ENV).
Tra i catalizzatori testati, Il nitruro di cerio caricato con Ni (CeN) ha mostrato le migliori prestazioni catalitiche grazie al suo ENV relativamente basso. Anche le prestazioni degli altri materiali testati erano direttamente correlate ai rispettivi ENV. Entusiasta dei risultati, Il professor Hosono osserva, "Possiamo ora proporre una regola generale per la progettazione di catalizzatori a base di nitruro per NH 3 sintesi, in cui il loro ENV domina le loro prestazioni catalitiche." In particolare, l'attività catalitica di Ni/CeN era paragonabile a quella dei catalizzatori a base di rutenio, rappresentando una potenziale alternativa ecologica composta da materiali più abbondanti.
Cosa c'è di più, il team ha anche notato che il caricamento di Ni su CeN non era nemmeno necessario; le vacanze di azoto in CeN possono anche innescare la dissociazione di H 2 molecole. "Il CeN da solo e con il caricamento di Ni ha dimostrato di produrre i catalizzatori più efficienti e stabili per la sintesi dell'ammoniaca tra i diversi catalizzatori di nitruro che abbiamo studiato, " spiega Ye. Il team spera che le informazioni ottenute da questo studio possano essere utili anche in applicazioni diverse dalla sintesi dell'ammoniaca. Kitano conclude, "Comprendere il ruolo dei nitruri può far luce sulla progettazione e sullo sviluppo di catalizzatori efficienti a base di metalli di transizione per altri processi chimici".