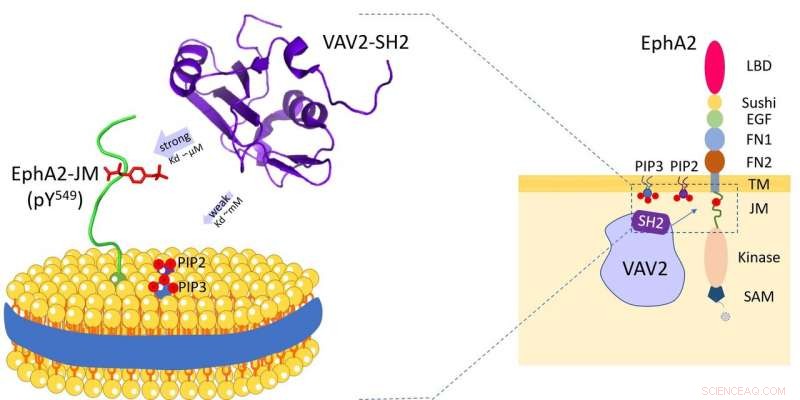
La proteina Vav2 si lega ai fosfolipidi della membrana cellulare e alla regione iuxtamembrana del recettore tirosina chinasi EphA2. Credito:HFIPS
Recentemente, un gruppo di ricerca guidato dal Prof. Wang Junfeng dell'High Magnetic Field Laboratory, Hefei Institutes of Physical Sciences ha rivelato la doppia specificità della proteina Vav2-SH2 dopo aver studiato il meccanismo di riconoscimento specifico della proteina Vav2 umana con i fosfolipidi della membrana cellulare e la regione iuxtamembrana EphA2 della tirosina chinasi del recettore.
Vav2 è ampiamente espresso nei tessuti umani e svolge ruoli essenziali in vari processi biologici. E attraverso il suo dominio Src-homology 2 (SH2), Vav2 è in grado di interagire con diversi recettori transmembrana. Queste interazioni mediate da SH2 avvengono sopra o vicino alla membrana plasmatica e sono essenziali per Vav2 per mediare la diversa trasduzione del segnale extracellulare.
In questa ricerca, con l'ausilio di tecniche di risonanza magnetica nucleare (NMR), i ricercatori hanno scoperto il ruolo dell'ambiente a doppio strato fosfolipidico sull'interazione proteina-proteina, offrendo un potenziale metodo per studiare questa interazione nello stesso ambiente in condizioni quasi fisiologiche.
I ricercatori hanno rivelato che il dominio Vav2-SH2 si è specificamente legato alla regione iuxtamembrana fosforilata Y594 utilizzando il suo sito di legame proteico conservato. interessante, aveva anche la capacità di legame fosfolipidico e il sito di legame fosfolipidi di Vav2-SH2, adiacente al sito di legame proteico, è stata determinata mediante esperimenti NMR.
Per di più, i ricercatori hanno utilizzato nanodischi lipidici per imitare la membrana, e ha scoperto il ruolo dell'ambiente di membrana nel modulare questo riconoscimento proteina-proteina.