Credito:Wiley
Alcuni farmaci utili sono costituiti da peptidi che agiscono sui loro bersagli proteici. Per renderli più efficienti e stabili, gli scienziati hanno trovato un modo per sostituire i segmenti cruciali dei peptidi con unità ureido. Queste oligouree, che sono composti da unità a base di urea, si ripiegano in una struttura simile a quella dei peptidi. I peptidi "falsi" a base di oligourea migliorano le opzioni per la progettazione razionale di farmaci, conclude lo studio pubblicato sulla rivista Angewandte Chemie .
Diversi farmaci sono peptidi che inibiscono o attivano le azioni di alcune proteine. Per aumentare la loro efficienza, gli scienziati stanno studiando i mimici dei peptidi. I mimici peptidici contengono filamenti di piccole unità organiche che assomigliano agli amminoacidi, i mattoni dei peptidi, ma non sono identici a loro. La logica è che gli enzimi proteolitici attaccheranno meno probabilmente questi falsi filamenti di peptidi, quindi i farmaci sarebbero più efficaci.
Però, i filamenti sintetici, chiamati oligomeri, devono ripiegarsi nella struttura del peptide originale per legarsi correttamente alla sua proteina bersaglio. Gilles Guichard e il suo team del CNRS, Università di Bordeaux, e colleghi dell'Università di Strasburgo e Ureka Pharma, Mulhouse, Francia, hanno esplorato oligomeri costituiti da unità ureido, che sono derivati dell'urea. Queste oligouree si piegano in un'elica, una delle strutture tipiche dei peptidi. Però, ci sono lievi differenze. "Le eliche di oligourea hanno meno residui per giro, un aumento minore per turno, e un diametro maggiore rispetto all'alfa-elica del peptide originale, "dice Guichard.
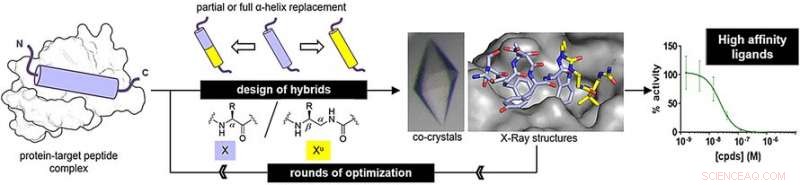
Per determinare se le oligouree potrebbero imitare le strutture peptidiche reali, i ricercatori hanno preparato ibridi peptide-oligourea e hanno studiato il loro legame con le proteine bersaglio. Uno degli obiettivi, MDM2, è un regolatore naturale della proteina soppressore tumorale p53. L'altro, VDR, è una proteina necessaria nella regolazione della crescita cellulare, immunità, e altre funzioni biologiche.
Per il mimo del peptide legante MDM2, i ricercatori hanno preparato ibridi sostituendo tre aminoacidi chiave terminali con unità ureido. Per il mimo del peptide VDR-binding, hanno sostituito il segmento medio dell'amminoacido con unità ureido. Dopo alcuni cicli di ottimizzazione, gli autori hanno trovato strutture ibride con elevate affinità di legame.
Le affinità di legame erano simili a quelle dei peptidi originali. Inoltre, L'analisi a raggi X ha rivelato che le strutture ibride adottavano una struttura elicoidale regolare. Però, le eliche erano ancora un po' più larghe e avevano spazi più grandi tra le catene laterali lungo lo scheletro dell'oligourea rispetto a quelli dei peptidi naturali.
Ci si aspetta che gli ibridi peptide-oligourea resistano alla degradazione proteolitica, un obiettivo importante nella chimica farmaceutica. Un altro vantaggio è che consentono più modifiche. "Gli alfa aminoacidi possono essere sostituiti in due posizioni, ma le unità ureido hanno un sito in più, ", afferma Guichard. Ciò significa che i farmaci ibridi peptide-oligourea offrono più opzioni per l'ottimizzazione.