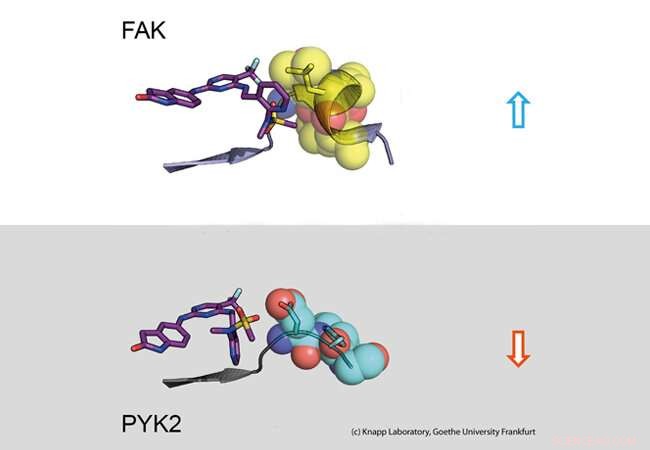
Parte superiore:tempo di permanenza lungo. Un inibitore (a sinistra:modello a bastoncino) si lega alla molecola segnale FAK (a destra:parte della proteina FAK rappresentata come modello di calotta con sfere). Il cambiamento strutturale di FAK provoca contatti idrofobici (giallo, cosiddetto motivo DFG) e un fidanzamento duraturo. Parte inferiore:breve tempo di permanenza. La proteina segnale PYK2 non cambia la sua struttura dopo il legame con l'inibitore, determinando così una rapida dissociazione dell'inibitore. Credito:Laboratorio Knapp, Università Goethe di Francoforte
Molti farmaci antitumorali bloccano i segnali nelle cellule tumorali che aiutano le cellule degenerate a moltiplicarsi in modo incontrollato ea staccarsi dai tessuti. Per esempio, bloccando la proteina di segnalazione FAK, una cosiddetta chinasi, fa sì che le cellule del cancro al seno diventino meno mobili e quindi meno soggette a metastasi. Il problema è che quando FAK è bloccato da un inibitore, la proteina di segnalazione strettamente correlata PYK2 diventa molto più attiva e quindi assume alcuni dei compiti di FAK. L'ideale sarebbe quindi un inibitore che inibisca allo stesso modo sia FAK che PYK2 il più a lungo possibile.
Un team internazionale guidato dal chimico farmaceutico Prof. Stefan Knapp dell'Università di Goethe ha studiato una serie di inibitori FAK appositamente sintetizzati. Tutti gli inibitori si legano alla proteina FAK all'incirca alla stessa velocità. Però, differivano nella durata del legame:l'inibitore più efficace è rimasto legato alla proteina di segnalazione FAK più a lungo.
Utilizzando analisi biologiche strutturali e molecolari e simulazioni al computer, il team di ricerca ha scoperto che il legame degli inibitori che rimangono nella tasca di legame FAK per lungo tempo induce un cambiamento strutturale. Così, attraverso il legame di questi inibitori, FAK cambia forma e forma uno specifico, struttura idrorepellente nei punti di contatto con l'inibitore, paragonabile a un abbraccio intimo.
La proteina strettamente correlata PYK2, d'altra parte, rimase relativamente rigido, e sebbene l'inibitore FAK più efficace bloccasse anche PYK2, il suo effetto era significativamente più debole a causa della rapida dissociazione degli inibitori dal sito di legame. interessante, le simulazioni al computer sono state in grado di prevedere molto bene la cinetica del legame, fornendo un metodo per una simulazione accurata dei tassi di dissociazione dei farmaci per l'ottimizzazione futura dei candidati farmaci.
Il prof. Stefan Knapp spiega, "Poiché ora abbiamo una migliore comprensione dei meccanismi molecolari dell'interazione di potenti inibitori di queste due chinasi, speriamo di essere in grado di utilizzare simulazioni al computer per prevedere meglio i tempi di permanenza dei farmaci degli inibitori e dei candidati ai farmaci in futuro. Finora, poca attenzione è stata dedicata alle proprietà cinetiche del legame dei farmaci. Però, questa proprietà è ora emersa come un parametro importante per lo sviluppo di farmaci più efficaci progettati per inibire le loro proteine bersaglio, come nel caso di FAK e PYK2, non solo potentemente ma anche per lungo tempo".