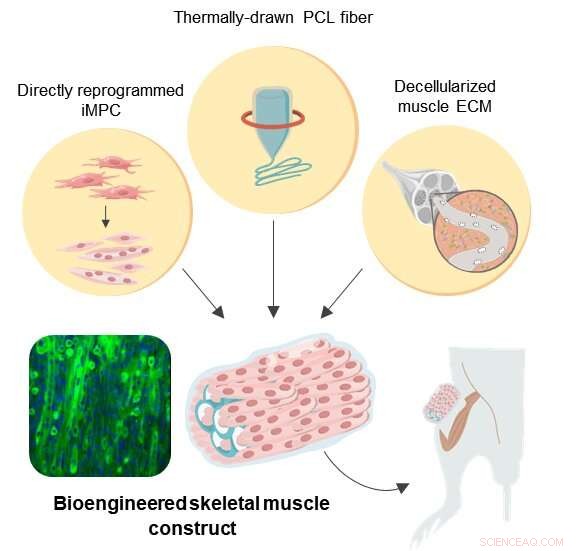
Illustrazione schematica dei costrutti bioingegnerizzati 3D simili a muscoli scheletrici Credito:Institute for Basic Science
Il muscolo costituisce l'organo più grande dell'uomo, che rappresentano il 40% della massa corporea, e svolge un ruolo essenziale nel mantenimento della vita. Il tessuto muscolare è noto per la sua capacità unica di rigenerazione spontanea. Però, in lesioni gravi come quelle subite in incidenti stradali o resezioni tumorali che provocano una perdita muscolare volumetrica (VML), la capacità di recupero del muscolo è notevolmente ridotta. Attualmente, I trattamenti VML comprendono interventi chirurgici con lembi o innesti muscolari autologhi accompagnati da terapia fisica. Però, le procedure chirurgiche spesso portano a una ridotta funzione muscolare, e in alcuni casi si traducono in un completo fallimento dell'innesto. Così, c'è una richiesta di opzioni terapeutiche aggiuntive per migliorare il recupero della perdita muscolare.
Una strategia promettente per migliorare la capacità funzionale del muscolo danneggiato consiste nell'indurre la rigenerazione de novo del muscolo scheletrico attraverso l'integrazione di cellule trapiantate. Diversi tipi di cellule, comprese le cellule satelliti (cellule staminali muscolari), mioblasti, e cellule staminali mesenchimali, sono stati usati per trattare la perdita muscolare. Però, biopsie muscolari invasive, scarsa disponibilità di cellule, e la limitata manutenzione a lungo termine impediscono la traduzione clinica, dove potrebbero essere necessari milioni o miliardi di cellule mature per fornire benefici terapeutici.
Un altro problema importante è controllare il microambiente tridimensionale nel sito della lesione per garantire che le cellule trapiantate si distinguano correttamente in tessuti muscolari con strutture desiderabili. Una varietà di biomateriali naturali e sintetici è stata utilizzata per migliorare la sopravvivenza e la maturazione delle cellule trapiantate durante il reclutamento di cellule ospiti per la rigenerazione muscolare. Però, ci sono irrisolti, dilemmi di lunga durata nello sviluppo dell'impalcatura tissutale. Gli scaffold naturali mostrano un alto riconoscimento cellulare e un'affinità di legame cellulare, ma spesso non riescono a fornire robustezza meccanica in lesioni di grandi dimensioni o tessuti portanti che richiedono un supporto meccanico a lungo termine. In contrasto, gli scaffold sintetici forniscono un'alternativa progettata con precisione con proprietà meccaniche e fisiche regolabili, così come strutture su misura e composizioni biochimiche, ma sono spesso ostacolati dalla mancanza di reclutamento cellulare e dalla scarsa integrazione con il tessuto ospite.

Immagine SEM dell'impalcatura PCL porosa con MEM Credit:Institute for Basic Science
Per superare queste sfide, un gruppo di ricerca presso il Center for Nanomedicine all'interno dell'Institute for Basic Science (IBS) a Seoul, Corea del Sud, Università Yonsei, e il Massachusetts Institute of Technology (MIT) hanno ideato un nuovo protocollo per la rigenerazione muscolare artificiale. Il team ha ottenuto un trattamento efficace della VML in un modello murino impiegando la tecnologia di riprogrammazione cellulare diretta in combinazione con uno scaffold ibrido naturale-sintetico.
Riprogrammazione cellulare diretta, chiamata anche conversione diretta, è una strategia efficiente che fornisce una terapia cellulare efficace perché consente la rapida generazione di cellule bersaglio specifiche del paziente utilizzando cellule autologhe dalla biopsia tissutale. I fibroblasti sono le cellule che si trovano comunemente all'interno dei tessuti connettivi, e sono ampiamente coinvolti nella guarigione delle ferite. Poiché i fibroblasti non sono cellule differenziate terminali, è possibile trasformarli in cellule progenitrici miogeniche indotte (iMPC) utilizzando diversi fattori di trascrizione. qui, questa strategia è stata applicata per fornire iMPC per l'ingegneria del tessuto muscolare.
Al fine di fornire un supporto strutturale alle cellule muscolari in proliferazione, policaprolattone (PCL), è stato scelto come materiale per la fabbricazione di un'impalcatura porosa per la sua elevata biocompatibilità. Mentre la lisciviazione del sale è un metodo ampiamente utilizzato per creare materiali porosi, è per lo più limitato alla produzione di strutture porose chiuse. Per superare questo limite, i ricercatori hanno potenziato il metodo convenzionale di lisciviazione del sale con la trafilatura termica per produrre scaffold in fibra PCL personalizzati. Questa tecnica ha facilitato la fabbricazione ad alta produttività di fibre porose con rigidità controllata, porosità, e dimensioni che consentono un adattamento preciso dei ponteggi ai siti della lesione.
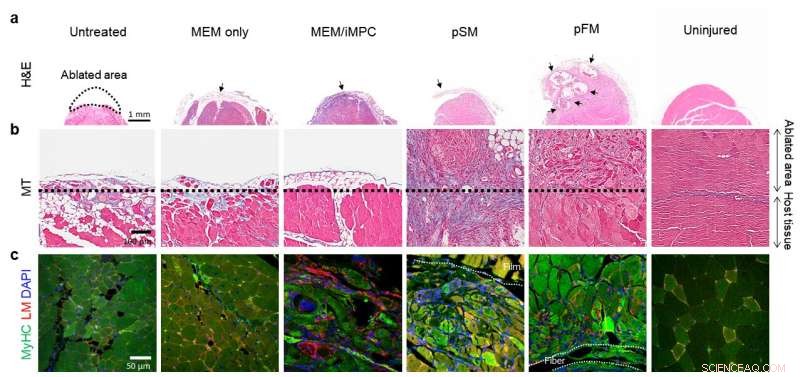
Recupero del tessuto muscolare ablato a) 1 settimana e b-c) 4 settimane dopo il trapianto Credito:Institute for Basic Science
Però, gli scaffold in fibra sintetica PCL da soli non forniscono segnali biochimici e meccanici locali ottimali che imitano il microambiente muscolo-specifico. Hence the construction of a hybrid scaffold was completed through the incorporation of decellularized muscle extracellular matrix (MEM) hydrogel into the PCL structure. Attualmente, MEM is one of the most widely used natural biomaterials for the treatment of VML in clinical practice. Così, the researchers believe that hybrid scaffolds engineered with MEM have a huge potential in clinical applications.
The resultant bioengineered muscle fiber constructs showed mechanical stiffness similar to that of muscle tissues and exhibited enhanced muscle differentiation and elongated muscle alignment in vitro. Per di più, implantation of bioengineered muscle constructs in the VML mouse model not only promoted muscle regeneration with increased innervation and angiogenesis but also facilitated the functional recovery of damaged muscles. The research team notes:"The hybrid muscle construct might have guided the responses of exogenously added reprogrammed muscle cells and infiltrating host cell populations to enhance functional muscle regeneration by orchestrating differentiation, paracrine effect, and constructive tissue remodeling."
Prof. Cho Seung-Woo from the IBS Center for Nanomedicine and Yonsei University College of Life Science and Biotechnology who led this study notes, "Further studies are required to elucidate the mechanisms of muscle regeneration by our hybrid constructs and to empower the clinical translation of cell-instructive delivery platforms."