Credito:Pohang University of Science &Technology (POSTECH)
Le cozze sopravvivono attaccandosi alle rocce nelle onde feroci o nelle maree sott'acqua. I materiali che imitano questa adesione subacquea sono ampiamente utilizzati per l'adesione cutanea o ossea, per modificare la superficie di un ponteggio, o anche nei sistemi di rilascio di farmaci o cellule. Però, questi materiali non hanno imitato del tutto le capacità delle cozze.
Un team di ricerca congiunto di POSTECH e Kangwon National University (KNU), guidato dal professor Hyung Joon Cha e dal Ph.D. il candidato Mincheol Shin del Dipartimento di Ingegneria Chimica del POSTECH con il Professor Young Mee Jeong e il Dr. Yeonju Park del Dipartimento di Chimica del KNU, ha analizzato Dopa e lisina, quali sono gli amminoacidi che compongono le proteine adesive superficiali secrete dalle cozze, e verificato che i loro ruoli siano correlati alla loro posizione. Il team ha compiuto un passo avanti nel rivelare il segreto dell'adesione sott'acqua scoprendo che questi amminoacidi possono contribuire all'adesione e alla coesione superficiale in modo diverso a seconda della loro posizione specifica.
La caratteristica delle proteine adesive delle cozze che sono state imitate finora è che contengono un gran numero di un unico amminoacido chiamato Dopa. La dopa è un amminoacido modificato con un altro gruppo ossidrile attaccato alla tirosina, e la ricerca sull'adesione subacquea è iniziata con il fatto che Dopa costituisce un grande componente della proteina adesiva.
Però, il team di ricerca ha messo in dubbio il fatto che questa eccellente adesione sottomarina delle cozze sia resa possibile da una sola molecola e si è concentrato sull'osservazione del numero e della posizione della lisina, che è un amminoacido frequente come Dopa.
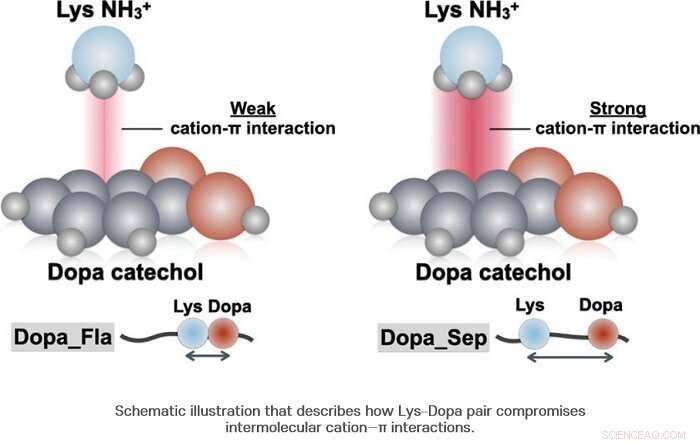
Di conseguenza, il gruppo di ricerca ha scoperto che la dopa e la lisina sono attaccate l'una all'altra con circa la metà delle probabilità. D'altra parte, è stato rivelato che a differenza di quanto finora noto, quando Dopa e lisina sono attaccati insieme, non sempre producono sinergie positive. I ricercatori hanno confermato che nel caso dell'interazione catione-π, sinergia negativa è piuttosto prodotta.
Quando Dopa e lisina sono insieme, una differenza nella densità delle molecole d'acqua si verifica a livello microscopico e la concentrazione delle molecole d'acqua intorno a Dopa si abbassa. Questa concentrazione ridotta consente una differenza nella forza del legame idrogeno tra l'anello benzenico e il gruppo ossidrile di Dopa, abbassando così la stabilità strutturale del complesso catione-π. Utilizzando la spettroscopia Raman, il gruppo di ricerca ha confermato che il CH 2 gruppo situato nella catena della lisina situata vicino a Dopa e catecolo dell'adiacente Dopa formano un'interazione intramolecolare, abbassandone così la stabilità.
I risultati di questo studio consentono di confermare come è stata progettata la proteina adesiva delle cozze, e promette di essere applicabile in futuro alla ricerca sulle proteine adesive di altri organismi.
"Con questa nuova scoperta sulla sinergia tra Dopa e lisina, che sono noti per svolgere sempre un ruolo positivo nell'adesione subacquea, cambierà la struttura del modo in cui i materiali adesivi sono progettati, " ha rimarcato il professor Hyung Joon Cha che ha guidato la ricerca.
Questa ricerca, che è stato recentemente pubblicato in Chimica dei materiali , è stato condotto nell'ambito dello studio intitolato "Comprensione del meccanismo di adesione subacquea degli organismi adesivi:controllo dell'equilibrio tra adesione e coesione superficiale, " che è un programma di ricerca a metà carriera del Ministero della scienza e delle TIC e della Fondazione nazionale per la ricerca della Corea.