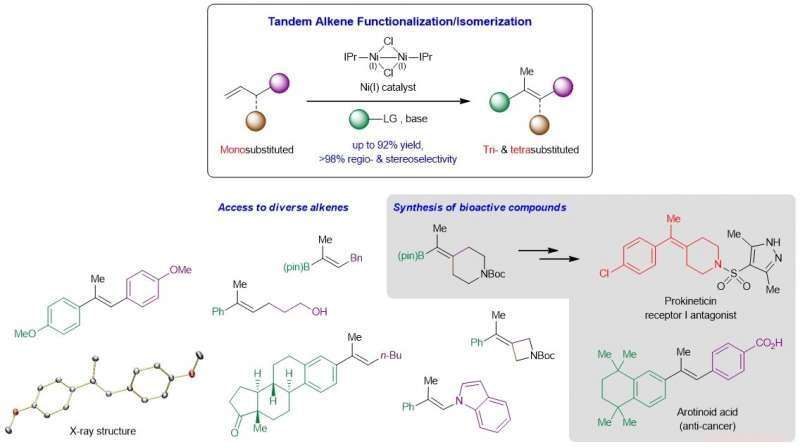
Schema che mostra lo sviluppo di un nuovo sistema catalizzato da Ni che converte olefine monosostituite economiche e facilmente disponibili in analoghi tri- e tetrasostituiti di alto valore, e la sua applicazione alla sintesi di composti bioattivi complessi. Credito: Catalisi della natura / Università Nazionale di Singapore
I chimici del NUS hanno sviluppato un nuovo modo per accedere a pregiati alcheni tri- e tetrasostituiti attraverso un processo tandem catalizzato da nichel che prevede una reazione di Heck seguita da migrazione del doppio legame carbonio-carbonio (C=C).
Lo sviluppo di metodi affidabili che forniscano alcheni aciclici tri- e tetrasostituiti stereochimicamente definiti è un obiettivo di vecchia data nella sintesi organica. Questi legami C=C altamente sostituiti risiedono comunemente in innumerevoli molecole di interesse inclusi materiali organici ed entità biologicamente attive, e sono intermedi chiave per un'ulteriore derivatizzazione verso uno spettro più ampio di prodotti di alto valore. Le reazioni esistenti che convertono i composti carbonilici o i legami carbonio-carbonio insaturi in olefine tri- e tetrasostituite spesso comportano lunghe vie sintetiche, mostrano una compatibilità limitata del gruppo funzionale, soffrono di un controllo regio- o stereoselettività insoddisfacente, e/o non sono sufficientemente generali. Una complicazione nasce dalla piccola differenza di energia tra il cis e trans isomeri di questi alcheni altamente sostituiti, che aumenta la difficoltà di generare questi composti in alta stereoselettività.
Un team di ricerca guidato dal Prof Koh Ming Joo, del Dipartimento di Chimica, National University of Singapore in collaborazione con il Prof Osvaldo Gutierrez, dell'Università del Maryland, ha concepito una strategia tandem che unisce la reazione di Heck regiocontrollata e la migrazione del legame C=C stereocontrollato in un unico passaggio (vedi Figura). Studi meccanicistici e computazionali hanno mostrato che la reazione procede attraverso un percorso non radicale, e che sia la considerevole base alcossidica che n -ligando di carbene eterociclico (NHC) sono cruciali per il processo catalitico.
Il professor Koh ha detto, "La nostra prima incursione in quest'area di ricerca è stata quella di chiederci ipoteticamente come possiamo trasformare α-olefine monosostituite, una classe molto abbondante di materie prime chimiche, agli analoghi trisostituiti e tetrasostituiti più preziosi ma difficili da sintetizzare, in un unico processo. Come risulta, la soluzione a questo era progettare una reazione in tandem che prima reagisse con il substrato monosostituito, quindi lo isomerizza al prodotto desiderato. Un controllo ben orchestrato della regio- e stereoselettività era fondamentale, che ci ha portato a scoprire l'efficacia unica dei catalizzatori di nichel legati con NHC".
"Ci aspettiamo che la nostra nuova metodologia migliori il modo in cui vengono sintetizzate molte molecole bioattive, e servire come modello per la progettazione di trasformazioni catalitiche in tandem per costruire importanti elementi costitutivi da materiali non preziosi, " ha aggiunto il prof.
Il team di ricerca prevede di sfruttare le intuizioni ottenute da questo lavoro per sviluppare nuove trasformazioni in tandem per facilitare la sintesi chimica fine.