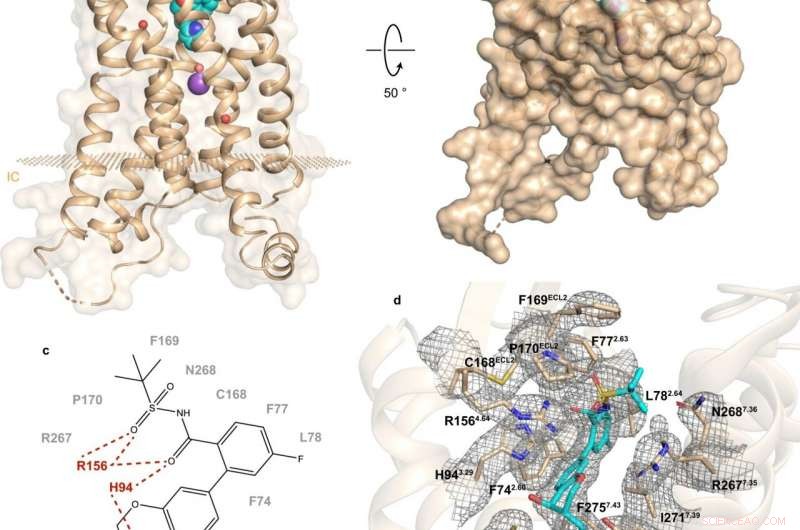
Fig. 1:Struttura e sito di legame di hBLT1. Credito:Michaelian, N., et al. Comunicazioni sulla natura , https://doi.org/10.1038/s41467-021-23149-1
Ricercatori della University of Southern California, Merck &Co., Skoltech, MIPT, UCLA, e l'Université de Sherbrooke hanno determinato la struttura del recettore 1 dei leucotrieni umani B4, coinvolto in processi infiammatori, infettivo, allergico, e malattie oncogene. Pubblicato in Comunicazioni sulla natura , l'analisi della struttura rivela come il recettore riconosce i suoi partner di legame e interagisce con essi. Ciò apre strade per la progettazione di farmaci migliori che colpiscano il recettore per il trattamento del diabete di tipo 2 e di altre patologie.
I recettori sono le apparecchiature a base di proteine utilizzate dalle cellule per ricevere e trasmettere segnali. Un recettore si attiva quando si lega a una molecola messaggera chiamata agonista, al che trasmette il segnale, che regola alcune funzioni biologiche. Antagonisti, al contrario, spegnere il recettore quando legato. Agonisti e antagonisti sono noti collettivamente come ligandi.
Il recettore umano 1 dei leucotrieni B4, o hBLT1, regola i processi correlati all'infiammazione, come il reclutamento di cellule T, nonché la proliferazione e la migrazione delle cellule muscolari lisce. Quel recettore è stato associato a malattie, compreso l'asma, influenza, artrite, aterosclerosi, diabete, e cancro.
Dalla sua scoperta nel 1997, ci sono stati numerosi tentativi di sviluppare ligandi hBLT1 per l'uso come farmaci, ma avevano molti effetti collaterali, bassa efficacia, e il corpo ha impiegato relativamente tempo per eliminarli. Una probabile spiegazione di ciò è che i ligandi hBLT1 utilizzati non sono specifici per quel recettore e si impegnano in altre interazioni indesiderate. Imparare di più sulla struttura del recettore e su come lega i ligandi può consentire ai farmacologi di progettare meglio, farmaci più selettivi.
Un recente studio condotto da una collaborazione russo-statunitense-canadese fa luce sulla composizione e sul funzionamento di hBLT1. Vadim Cherezov, professore di chimica all'USC e capo del Laboratorio MIPT per la biologia strutturale dei GPCR, ha commentato:"Abbiamo determinato la struttura cristallina con risoluzione di 2,9 angstrom del recettore hBLT1 in complesso con un antagonista selettivo, MK-D-046, sviluppato da Merck &Co. Questa struttura dovrebbe aiutare a progettare razionalmente terapie migliori per trattare il diabete di tipo 2 e altre condizioni infiammatorie".
La determinazione della struttura è stata completata da studi di mutagenesi e attracco sito-diretti, un metodo sperimentale e computazionale, rispettivamente. Secondo l'assistente professore di Skoltech Petr Popov, "questo ha permesso di rivelare i determinanti chiave delle interazioni intermolecolari tra il recettore e i ligandi".
L'analisi della struttura di hBLT1 rivela come il recettore riconosce e lega i ligandi, suggerendo un putativo canale di accesso al ligando sepolto nella membrana del recettore. Più specificamente, i risultati suggeriscono i possibili modi in cui il recettore potrebbe legare i suoi agonisti endogeni. Questo è, composti prodotti naturalmente dall'organismo per legarsi a quel recettore e attivarlo.
Migliorando la nostra comprensione della struttura e del funzionamento di hBLT1, lo studio apre possibilità per la progettazione di farmaci basata sulla struttura.