Credito:Massachusetts Institute of Technology
Le reazioni elettrochimiche che vengono accelerate utilizzando catalizzatori sono al centro di molti processi per la produzione e l'utilizzo di combustibili, sostanze chimiche, e materiali, compreso lo stoccaggio di elettricità da fonti energetiche rinnovabili in legami chimici, una capacità importante per la decarbonizzazione dei carburanti per il trasporto. Ora, la ricerca al MIT potrebbe aprire la porta a modi per rendere più attivi alcuni catalizzatori, e quindi migliorare l'efficienza di tali processi.
Un nuovo processo di produzione ha prodotto catalizzatori che hanno aumentato di cinque volte l'efficienza delle reazioni chimiche, potenzialmente consentendo nuovi processi utili in biochimica, chimica organica, chimica ambientale, ed elettrochimica. I risultati sono descritti oggi sulla rivista Catalisi della natura , in un articolo di Yang Shao-Horn, un professore del MIT di ingegneria meccanica e di scienza e ingegneria dei materiali, e membro del Research Lab of Electronics (RLE); Tao Wang, un postdoc in RLE; Yirui Zhang, uno studente laureato presso il Dipartimento di Ingegneria Meccanica; e altri cinque.
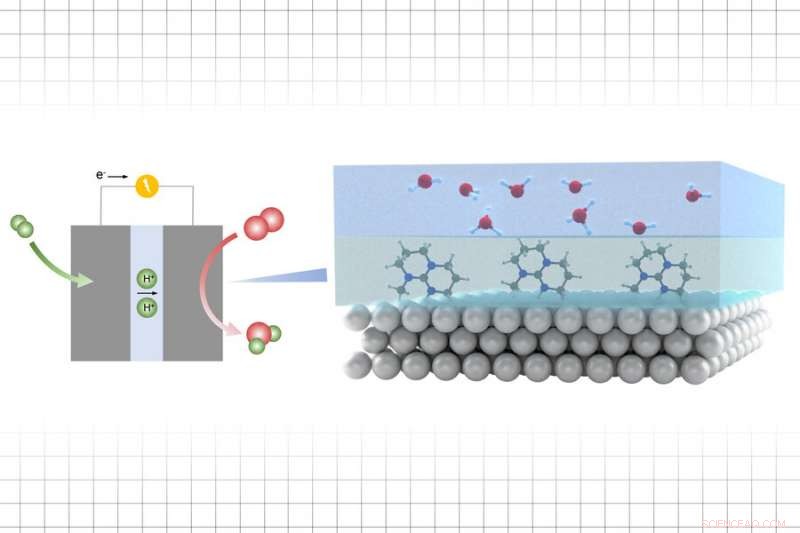
Il processo prevede l'aggiunta di uno strato di quello che viene chiamato un liquido ionico tra un catalizzatore di oro o platino e una materia prima chimica. I catalizzatori prodotti con questo metodo potrebbero potenzialmente consentire una conversione molto più efficiente del combustibile a idrogeno per alimentare dispositivi come celle a combustibile, o conversione più efficiente dell'anidride carbonica in combustibili.
"C'è un urgente bisogno di decarbonizzare il modo in cui alimentiamo il trasporto oltre i veicoli leggeri, come produciamo combustibili, e come produciamo materiali e prodotti chimici, " dice Shao-Horn, sottolineando il pressante appello alla riduzione delle emissioni di carbonio evidenziato nell'ultimo rapporto IPCC sui cambiamenti climatici. Questo nuovo approccio al potenziamento dell'attività catalitica potrebbe fornire un passo importante in quella direzione, lei dice.
L'utilizzo dell'idrogeno in dispositivi elettrochimici come le celle a combustibile è un approccio promettente ai settori della decarbonizzazione come l'aviazione e i veicoli pesanti, e il nuovo processo può aiutare a rendere pratici tali usi. Attualmente, la reazione di riduzione dell'ossigeno che alimenta tali celle a combustibile è limitata dalla sua inefficienza. I precedenti tentativi di migliorare tale efficienza si sono concentrati sulla scelta di diversi materiali catalitici o sulla modifica della loro composizione e struttura superficiale.
In questa ricerca, però, invece di modificare le superfici solide, il team ha aggiunto uno strato sottile tra il catalizzatore e l'elettrolita, il materiale attivo che partecipa alla reazione chimica. Lo strato liquido ionico, hanno trovato, regola l'attività dei protoni che contribuiscono ad aumentare la velocità delle reazioni chimiche che avvengono sull'interfaccia.
Poiché esiste una grande varietà di tali liquidi ionici tra cui scegliere, è possibile "sintonizzare" l'attività del protone e le velocità di reazione per abbinare l'energia necessaria per i processi che coinvolgono il trasferimento di protoni, che può essere utilizzato per produrre combustibili e sostanze chimiche attraverso reazioni con l'ossigeno.
"L'attività del protone e la barriera per il trasferimento di protoni è governata dallo strato di liquido ionico, e quindi c'è una grande sintonizzabilità in termini di attività catalitica per le reazioni che coinvolgono il trasferimento di protoni ed elettroni, " dice Shao-Horn. E l'effetto è prodotto da un sottile strato di liquido, spessore di pochi nanometri, al di sopra del quale si trova uno strato molto più spesso del liquido che deve subire la reazione.
"Penso che questo concetto sia nuovo e importante, "dice Wang, il primo autore dell'articolo, "perché le persone sanno che l'attività del protone è importante in molte reazioni elettrochimiche, ma è molto impegnativo da studiare." Questo perché in un ambiente acquatico, ci sono così tante interazioni tra le molecole d'acqua vicine coinvolte che è molto difficile distinguere quali reazioni stanno avvenendo. Utilizzando un liquido ionico, i cui ioni possono formare ciascuno un solo legame con il materiale intermedio, è stato possibile studiare le reazioni in dettaglio, utilizzando la spettroscopia infrarossa.
Di conseguenza, Wang dice, "La nostra scoperta evidenzia il ruolo fondamentale che gli elettroliti interfacciali, in particolare il legame idrogeno intermolecolare, può giocare nel potenziare l'attività del processo elettrocatalitico. Fornisce inoltre approfondimenti fondamentali sui meccanismi di trasferimento di protoni a livello della meccanica quantistica, che può spingere le frontiere del sapere come i protoni e gli elettroni interagiscono alle interfacce catalitiche".
"Il lavoro è anche entusiasmante perché offre alle persone un principio di progettazione su come mettere a punto i catalizzatori, " dice Zhang. "Abbiamo bisogno di alcune specie proprio in un 'punto debole', non troppo attivo o troppo inerte, per aumentare la velocità di reazione".
Con alcune di queste tecniche, dice Reshma Rao, un neolaureato al MIT e ora un postdoc all'Imperial College, Londra, che è anche coautore del documento, "vediamo un aumento fino a cinque volte dell'attività. Penso che la parte più eccitante di questa ricerca sia il modo in cui apre una dimensione completamente nuova nel modo in cui pensiamo alla catalisi". Il campo aveva colpito "una specie di posto di blocco, " lei dice, nel trovare modi per progettare materiali migliori. Concentrandosi sullo strato liquido piuttosto che sulla superficie del materiale, "è un modo completamente diverso di vedere questo problema, e apre una dimensione completamente nuova, un asse completamente nuovo lungo il quale possiamo cambiare le cose e ottimizzare alcune di queste velocità di reazione".