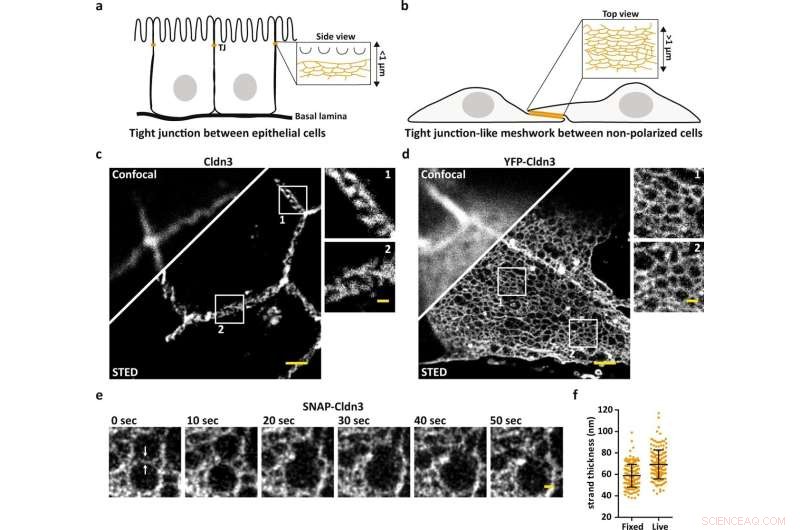
La microscopia STED rivela l'organizzazione su scala nanometrica delle reti TJ. uno schema che illustra il TJ endogeno al contatto cellula-cellula più apicale nelle cellule epiteliali. b Schema che illustra un reticolo simile a TJ formato in aree piatte sovrapposte di cellule non polarizzate trasfettate con claudina. c, d Immagine confocale e STED rappresentativa di una TJ formata endogena etichettata per Cldn3 (2°-Atto647N) tra le cellule epiteliali del tessuto del duodeno di topo (c) e il reticolo simile a TJ formato da YFP-Cldn3 sovraespresso (α-GFP-NB- Atto647N) tra due celle COS-7 (d). e Serie temporali STED a un colore rappresentative (1 fotogramma/10 s) di un reticolo simile a TJ in una regione sovrapposta di cellule COS-7 viventi che esprimono SNAP-Cldn3 (BG-JF646). Le frecce bianche indicano la rottura iniziale del filo seguita dalla fusione di due maglie più piccole in una maglia più grande. È stata applicata una sfocatura gaussiana con un sigma di 20 nm. f Misurazione full-wide-half-massima (FWHM) di filamenti TJ di SNAP-Cldn3 (BG-JF646) in cellule COS-7 fisse e viventi. I dati rappresentano la media ± DS. Ogni punto dati rappresenta un profilo di linea di un totale di 160 profili di linea da 8 reticoli indipendenti simili a TJ (n = 160). La FWHM complessiva ha prodotto 59 ± 11 nm per campioni fissi e 69 ± 14 nm per campioni viventi. Tutte le immagini rappresentative derivano da 3 esperimenti indipendenti. Barre di scala, 1 µm (c, d) e 200 nm (ingrandimenti in c, d ed e). Credito:Comunicazioni sulla natura (2022). DOI:10.1038/s41467-022-32533-4
Sigillano le cellule epiteliali e, in determinate condizioni, consentono il passaggio di ioni e acqua:giunzioni strette formano una barriera paracellulare nei tessuti e la loro disfunzione è associata a malattie. Sebbene i loro componenti molecolari siano noti sin dagli anni '90, non è chiaro come siano organizzate le 26 proteine chiamate claudine.
Gli scienziati della Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) hanno ora acquisito approfondimenti sulla struttura delle giunzioni strette, utilizzando la microscopia a deplezione di emissioni stimolate (STED) a super risoluzione. È la prima volta che viene descritto il meccanismo di base alla base di tutte le proprietà della barriera epiteliale.
Le giunzioni strette (TJ) sono normalmente eccellenti nel consentire il passaggio di ioni o molecole necessari, mentre formano una barriera densa per impedire ai batteri indesiderati e alle loro tossine di entrare nel corpo. Queste barriere paracellulari, che possono essere contemporaneamente canali ionici e canali d'acqua selettivi, si trovano ovunque si incontrano cellule epiteliali o cellule endoteliali, cioè dove diversi tessuti sono collegati tra loro o quando il lume di un organo deve essere sigillato dal flusso sanguigno.
L'esistenza di giunzioni strette è stata scoperta circa 60 anni fa e i loro principali componenti molecolari sono noti da 30 anni:26 proteine di membrana chiamate claudine. A seconda della cellula, le claudine sono organizzate in varie costellazioni per formare reti semipermeabili larghe fino a diverse centinaia di nanometri. Di solito, più claudine si uniscono, ma alcune barriere sono costituite solo da una o due proteine strutturali.
Ma la domanda è:come sono organizzate le claudine in modo da creare proprietà barriera diverse a seconda della cellula o del tessuto in questione? E fino a che punto i claudini dipendono l'uno dall'altro nel processo? Finora, queste domande sono rimaste senza risposta perché era impossibile vedere attraverso la struttura dei fili, che sono spessi solo una decina di nanometri. Ora gli scienziati dell'FMP sono riusciti a fare proprio questo utilizzando la microscopia STED.
"Questo tipo di microscopia a super risoluzione e un eccellente team di biologi cellulari, informatici e fisiologi ci hanno aiutato a far luce sull'architettura molecolare delle giunzioni strette", ha affermato il dottor Martin Lehmann, capo del Cellular Imaging Group, ultimo autore di lo studio. "Siamo ora in grado per la prima volta di descrivere il meccanismo alla base delle principali proprietà della barriera epiteliale."
Utilizzo di STED per risolvere singole meshwork
Normalmente, la risoluzione dei microscopi a fluorescenza è limitata a circa 250 nanometri. Utilizzando la microscopia STED, sono possibili 50 nanometri o meno. Questo ha letteralmente dato ai ricercatori una maggiore comprensione.
"Con la microscopia a fluorescenza standard, non saremmo mai penetrati nella densa organizzazione della giunzione stretta, ma STED ci ha consentito di risolvere le singole mesh della rete. Di conseguenza, ora siamo in grado di determinare l'esatta posizione delle proteine, poiché oltre a vedere se le claudine si mescolano o si separano e come segregano", afferma Hannes Gonschior, il primo autore dello studio, che ha condotto il suo dottorato di ricerca. tesi sul tema al FMP. "Questa organizzazione su scala nanometrica era precedentemente sconosciuta."
In primo luogo, gli studi sono stati condotti a livello cellulare e poi nel tessuto intestinale e renale dei topi. Immagini sorprendenti hanno riprodotto le proteine etichettate in modo fluorescente in diversi colori, mostrando dove si trovano quali proteine si trovano e come si incatenano per formare una cerniera colorata.
Tre risultati dello studio, ora pubblicati su Nature Communications , sono di particolare rilievo:
Creazione di un modello per la scoperta di farmaci
Il fatto che i ricercatori FMP siano stati in grado di determinare per la prima volta l'organizzazione su scala nanometrica delle giunzioni strette è un grande successo per la ricerca di base. Ma anche la medicina può trarre vantaggio dalla svolta. Questo perché le mutazioni nelle claudine svolgono un ruolo in una serie di malattie ereditarie, la più ovvia è la sindrome HELIX, una condizione rara che causa una ridotta produzione di sudore.
Il colpevole è una mutazione nella claudina 10b, che causa ipoidrosi e difetti delle ghiandole lacrimali e salivari, oltre a una ridotta regolazione del calcio e del magnesio nel rene. Il team di ricercatori aveva anche sperimentato questo mutante della malattia.
"La nostra ricerca è ancora lontana dall'avere rilevanza clinica", ha affermato il biofisico Martin Lehmann, valutando i loro risultati. "Ma almeno ora capiamo come sono strutturate queste reti. Questo è il primo passo, che ci permetterà di cercare piccole molecole che aprano o chiudano queste barriere."
Il biologo cellulare Hannes Gonschior ha aggiunto che "hanno trovato un modello semplificato per la scoperta di farmaci e, più in generale, hanno condotto ricerche sul passaggio paracellulare degli ioni. È molto probabile che le nostre scoperte ci consentiranno di comprendere fenotipi e sintomi clinici precedentemente inspiegabili, con un difetto in una di queste particolari barriere paracellulari". + Esplora ulteriormente