I farmaci contenenti oro sono stati usati per secoli per trattare condizioni come l'artrite reumatoide. Inoltre, potrebbero essere efficaci contro il cancro e l'HIV. Un meccanismo con cui funzionano potrebbe verificarsi perché gli ioni d'oro estraggono gli ioni di zinco dalle dita di zinco:in loop, domini proteici che legano gli acidi nucleici. Ricercatori americani hanno caratterizzato tali "dita d'oro" utilizzando la spettrometria di massa a mobilità ionica. Come riportato sulla rivista Angewandte Chemie , hanno identificato i siti esatti di legame dell'oro.
"Gli ioni di zinco nelle dita di zinco si legano a quattro atomi di zolfo o azoto dei residui di cisteina e istidina della proteina, " spiega Nicholas P. Farrell della Virginia Commonwealth University (Richmond, STATI UNITI D'AMERICA). "Gli ioni d'oro si legano a soli due frammenti di amminoacidi e modificano la conformazione della proteina. Le "dita d'oro" non sono più in grado di legarsi agli acidi nucleici, che può essere terapeuticamente utile."
Sebbene ci siano una varietà di potenziali siti di legame per gli ioni metallici, ogni metalloproteina solitamente preferisce una singola conformazione. In precedenza non era possibile determinare dove si trovassero i siti di legame specifici in una miscela di conformeri. Farrell e il suo team hanno ora esaminato da vicino due dita d'oro. Secondo Farrell, "la sostituzione dello zinco nel dito di zinco 3 del fattore di trascrizione Sp1 porta a una sola specie di dito d'oro". I ricercatori hanno identificato questo come un legame Cys-Au-His lineare. Nel caso della proteina nucleocapside dell'HIV, che svolge un ruolo fondamentale nella replicazione del virus, "mettendo oro nel dito di zinco 2 della proteina (NCp7-F2), conduce a tre diverse specie di dita d'oro con motivi lineari Cys-Au-Cys, uno dei quali è nettamente predominante."
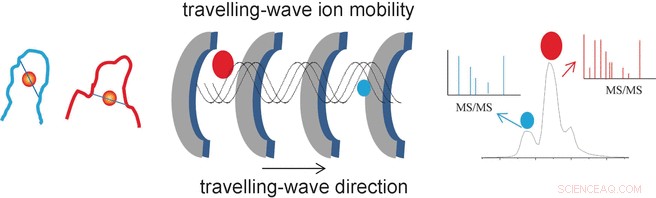
Il successo dei ricercatori deriva dall'uso di uno speciale metodo analitico chiamato spettrometria di massa a mobilità ionica a onde mobili (TWIM-MS). In questa tecnica, le molecole da analizzare vengono ionizzate e gli ioni accelerati da un campo elettrico in un gas. Le collisioni con le molecole di gas causano il rallentamento degli ioni. Grande, le molecole voluminose sono rallentate più che piccole, quelli compatti perché si scontrano più frequentemente. Ciò rende possibile differenziare e separare anche gli isomeri, perché pur avendo la stessa massa, le loro diverse geometrie determinano una mobilità diversa. Una volta separati in base alla loro mobilità, i singoli ioni possono ora essere frammentati mediante dissociazione indotta da collisione (CID) ei frammenti misurati nuovamente mediante spettrometria di massa. Ciò rende possibile caratterizzare peptidi più corti che rimangono legati all'oro.
"In questo modo, siamo stati in grado di identificare i siti e le modalità di legame specifici per le dita di zinco modificate con oro NCp7-F2 e Sp1-F3, " dice Farrell. "La spettrometria di massa a mobilità ionica fornisce quindi importanti informazioni sui cambiamenti nella geometria causati dallo scambio di zinco nelle proteine a dita di zinco, così come la selettività e la reattività di tali reazioni. Questo potrebbe essere di beneficio nella ricerca di nuovi farmaci antivirali e antitumorali a base di metalli».