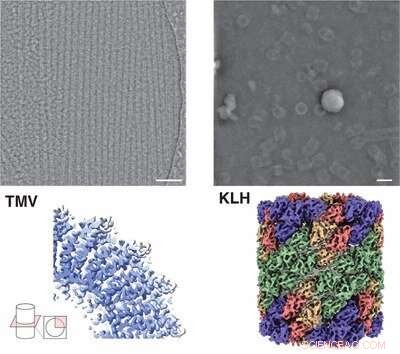
Immagine microscopica (in alto) e struttura (in basso) della proteina emocianina (a destra) e virus del mosaico del tabacco (a sinistra) di iDPC-STEM. Sotto le corrispondenti strutture 3D con risoluzione 3,5 e 6,5 Å. Crediti:Forschungszentrum Jülich / Ivan Lazic, Carsten Sachse
I ricercatori del Forschungszentrum Jülich e dell'Università Heinrich Heine di Düsseldorf guidati dal Prof. Dr. Carsten Sachse stanno usando la microscopia crioelettronica, o in breve crio-EM, per rendere visibili le biomolecole a livello atomico. In un articolo ora pubblicato sulla rivista Nature Methods , presentano un nuovo metodo che combina la crio-EM con un metodo altrimenti utilizzato nella ricerca sui materiali. I risultati sono anche presentati e classificati in una Natura Riunione.
La tecnica ancora relativamente nuova della crio-EM ha un vantaggio decisivo rispetto alla cristallografia a raggi X che è stata utilizzata di routine per decenni:i blocchi costitutivi delle proteine possono essere osservati nel loro ambiente naturale in uno stato congelato senza doverli convertire in un cristallo artificiale in anticipo. Cryo-EM si basa sulla microscopia elettronica a trasmissione. Il metodo alternativo che i ricercatori hanno ora impiegato, d'altra parte, è un ulteriore sviluppo della microscopia elettronica a trasmissione a scansione con contrasto di fase differenziale integrato, o in breve iDPC-STEM.
"Finora questo metodo è stato utilizzato principalmente nella ricerca sui materiali, dove ha già portato a risoluzioni molto elevate. Durante l'imaging di campioni biologici, ora abbiamo raggiunto direttamente una qualità resa possibile dalla microscopia crioelettronica alcuni anni fa, " afferma Carsten Sachse, Direttore dell'Ernst Ruska-Centre di Forschungszentrum Jülich e Professore all'Università Heinrich Heine di Düsseldorf.
Insieme ai partner di ricerca della società di analisi Thermo Fisher Scientific di Eindhoven, è stato in grado di mappare le strutture proteiche utilizzando iDPC-STEM con una risoluzione sub-nanometrica di 3,5 angstrom. "La microscopia crioelettronica oggi è un po' più avanzata rispetto a quella attuale. Ma i nostri risultati mostrano che iDPC-STEM è in linea di principio in grado, con una certa ottimizzazione, di ottenere risoluzioni simili alla crio-EM di oggi e di espandere le possibilità di analisi strutturale; specialmente per campioni molto eterogenei e non uniformi o singole particelle quando le capacità di media sono limitate", afferma Carsten Sachse.

Rendering artistico dell'approccio della microscopia elettronica a trasmissione a scansione (STEM):un piccolo raggio di elettroni raster sopra il campione a piccoli passi per illuminare le biomolecole congelate a scatto nel ghiaccio. Credito:Forschungszentrum Jülich / Daniel Mann, Carsten Sachse
Nella microscopia crioelettronica convenzionale, migliaia, a volte decine o centinaia di migliaia, di istantanee di un campione vengono acquisite da molte direzioni di visualizzazione. Un potente computer utilizza queste immagini per calcolare un modello tridimensionale dettagliato della molecola o particella. La microscopia elettronica a scansione, d'altra parte, scansiona gli oggetti linea per linea in piccoli passaggi per produrre un'immagine composita che, come nella crio-EM convenzionale, funge da base per il calcolo della struttura tridimensionale. Come con la microscopia crioelettronica, viene utilizzato un fascio di elettroni a bassa dose perché le biomolecole sono in genere estremamente sensibili. Ciò impedisce all'elevata energia del raggio di distruggere le strutture sensibili. + Esplora ulteriormente