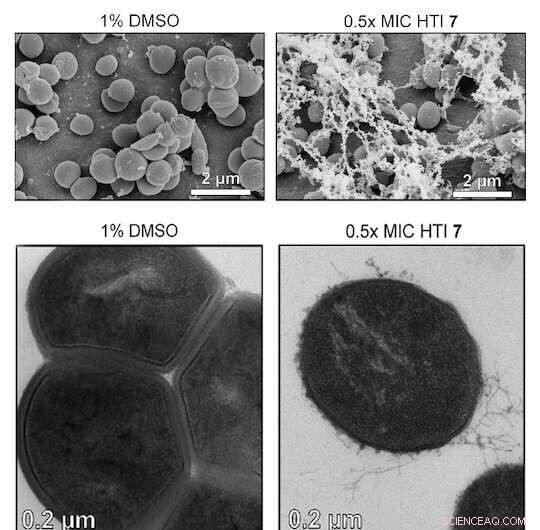
Credito:Scienze avanzate (2022). DOI:10.1002/advs.202203242
Una nuova classe di molecole motorizzate che uccidono batteri specifici promette di frenare la minaccia della resistenza agli antibiotici per la salute umana.
Gli scienziati della Rice University hanno guidato un team che ha sviluppato molecole di emitioindaco (HTI) attivate dalla luce che distruggono i batteri Gram-positivi e i biofilm che formano. Le molecole lo fanno potenziando la generazione locale di specie reattive dell'ossigeno (ROS) che attaccano chimicamente e distruggono le cellule resistenti ai farmaci.
Le nuove molecole differiscono e sono complementari ad altre create da Rice che sono anch'esse attivate dalla luce ma perforano le membrane cellulari per ucciderle.
Come le esercitazioni basate sul lavoro vincitore del Premio Nobel di Bernard Feringa, le molecole a base di HTI sono attivate dalla luce visibile anziché dai dannosi raggi ultravioletti.
Entrambi sono prodotti del chimico della Rice James Tour e dei suoi colleghi. Alumni Rice Ana Santos, ricercatrice post-dottorato presso l'Health Research Institute delle Isole Baleari a Palma, in Spagna, e Alexis van Venrooy, ora scienziato senior presso Genesis Therapeutics, San Diego, sono co-autori principali del nuovo studio in Scienze avanzate .
Le macchine molecolari basate su HTI sono costituite da due metà:un'unità tioindaco collegata a un carbociclo tramite un doppio legame centrale di carbonio. Quando viene attivata dalla luce visibile, la molecola subisce un cambiamento conformazionale che si traduce in un movimento a 360 gradi simile a un trapano o in uno spostamento tra due conformazioni, come un interruttore "on/off", a seconda del design molecolare.
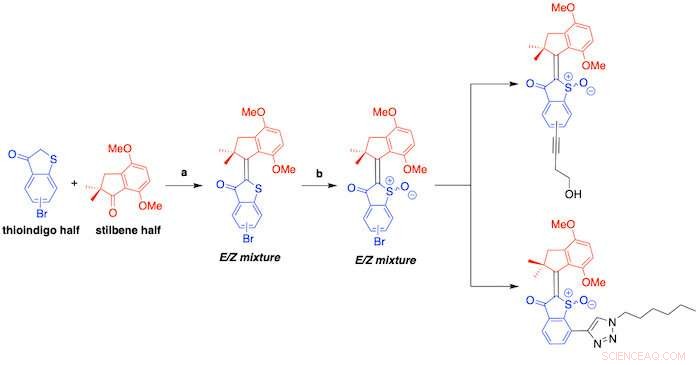
Uno schema mostra la sintesi dell'emitioindaco descritta in un nuovo studio condotto dai ricercatori della Rice. I motori molecolari sono attivati dalla luce visibile e uccidono i batteri nocivi generando specie reattive dell'ossigeno. Credito:il Gruppo Turistico
Nel processo, gli HTI attivati reagiscono con la cellula e l'ossigeno molecolare, trasferendo elettroni per produrre ROS che colpiscono le cellule bersaglio.
"Queste non stanno uccidendo le cellule strappando meccanicamente le membrane come fanno le prime", ha detto Tour. "Inducono un'interruzione sufficiente che le specie reattive dell'ossigeno e i radicali liberi vengono generati e finiscono per uccidere le cellule.
"Quindi non è la rapida morte necrotica che abbiamo visto prima", ha detto. "È un po' più lento, ma è estremamente efficiente."
"Un importante vantaggio di queste molecole è che hanno uno spettro ristretto di attività e uccidono selettivamente un gruppo specifico di batteri, i batteri Gram-positivi", ha detto Santos. "Pertanto, è meno probabile che causino gli effetti collaterali osservati con antibiotici ad ampio spettro che uccidono indiscriminatamente sia i batteri "cattivi" che quelli "buoni", e hanno anche meno probabilità di portare a resistenza perché solo un gruppo di batteri è interessato. "
I batteri Gram-positivi mancano di una membrana esterna (sebbene abbiano uno spesso strato di peptidoglicano) e questo sembra renderli più suscettibili ai ROS che si ossidano e distruggono le loro pareti cellulari.
I ricercatori hanno testato diverse varianti HTI su sette ceppi di batteri Gram-positivi e hanno scoperto che la molecola li uccideva tutti in presenza di luce. (Gli HTI erano meno efficaci sui batteri Gram-negativi, presumibilmente perché la loro doppia membrana impedisce all'HTI di entrare nella cellula. Ma permeabilizzarli con una soluzione tampone Tris-EDTA li rendeva più facilmente uccisi dagli HTI.)
Hanno anche esposto colonie di Staphylococcus aureus con e senza la presenza di scavenger di ROS e hanno scoperto che quelle con scavenger hanno ridotto l'efficacia delle molecole di emitioindaco. Senza spazzini, il ROS ha avuto l'effetto desiderato sui batteri.
Lo studio ha mostrato che gli HTI hanno anche ucciso le cellule persistenti tolleranti agli antibiotici di diversi ceppi Gram-positivi in appena 25 minuti, più velocemente degli antibiotici convenzionali. In ogni caso, l'esposizione ripetuta agli HTI non ha aumentato la resistenza dei batteri al trattamento.
Poiché il trattamento si basa sui ROS piuttosto che sull'azione meccanica, non danneggia le cellule dei mammiferi, ha affermato Santos. "Questo apre la strada a una nuova terapia antimicrobica in grado di colpire in sicurezza i patogeni Gram-positivi associati alle infezioni della pelle come le ustioni", ha affermato.
"I risultati aiutano anche ad approfondire la nostra comprensione delle macchine molecolari in generale, dimostrando che non tutte agiscono con gli stessi meccanismi e che le differenze nel nucleo chimico della molecola possono provocare azioni biologiche molto diverse". + Esplora ulteriormente