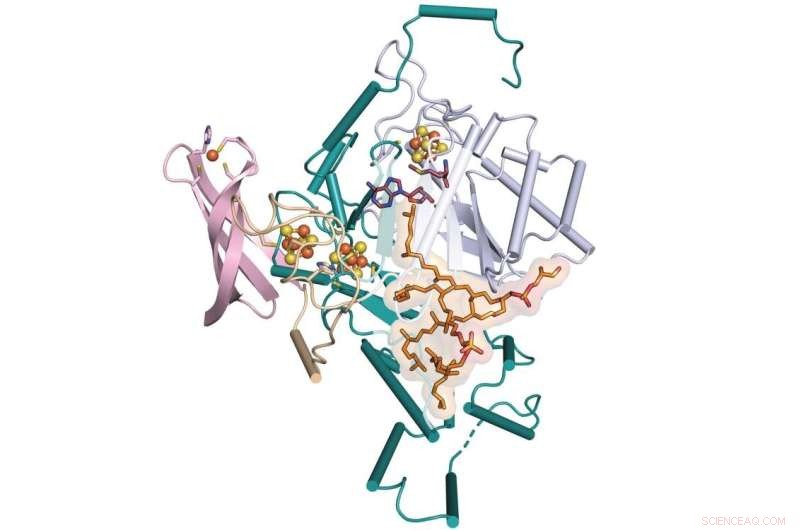
Un team di Penn State e l'Università dell'Illinois Urbana-Champaign ha determinato il passaggio mancante nella formazione di una molecola chiamata GDGT, che è un candidato promettente per l'uso come indicatore del clima passato. Il team ha determinato la struttura cristallina dei raggi X di un enzima che facilita questo processo chiamato GDGT/MAS, mostrato qui legato a cofattori aggiuntivi. Credito:Booker Lab/Penn State
Il passaggio mancante nella formazione di una molecola lipidica che consente ad alcuni organismi unicellulari di sopravvivere negli ambienti più estremi della Terra è stato ora decifrato. Questa nuova comprensione, scoperta da un team di biochimici della Penn State e dell'Università dell'Illinois Urbana-Champaign, potrebbe migliorare la capacità dei lipidi di essere utilizzati come indicatore della temperatura nel tempo geologico.
Il lipide, chiamato glicerolo dibifitanil glicerolo tetraetere (GDGT), si trova nella membrana cellulare di alcune specie di archaea, organismi unicellulari che originariamente si pensava fossero batteri ma ora sono considerati un gruppo separato. Questo lipide fornisce la stabilità ad alcune specie per prosperare in ambienti con temperature, salinità o acidità estremamente elevate, come prese d'aria termali nell'oceano, sorgenti termali e acque ipersaline. La stabilità unica del GDGT consente inoltre di rilevarlo centinaia o addirittura migliaia di anni dopo la morte dell'organismo. Poiché questi organismi tendono a produrre più GDGT a temperature più elevate, è considerato un candidato promettente per la stima della temperatura nel tempo geologico.
"Affinché il GDGT possa essere utilizzato accuratamente come proxy per ricostruire i cambiamenti nelle temperature geologiche, gli scienziati devono capire meglio come è fatto, quali geni codificano per esso e quali specie possono crearlo", ha affermato Squire Booker, biochimico della Penn State , ricercatore presso l'Howard Hughes Medical Institute e leader del gruppo di ricerca. "Ma, fino ad ora, c'è stato un passaggio mancante nella formazione di questo lipide. Abbiamo utilizzato tecniche di imaging abbinate a metodi chimici e biochimici per decostruire il percorso chimico di questo passaggio mancante."
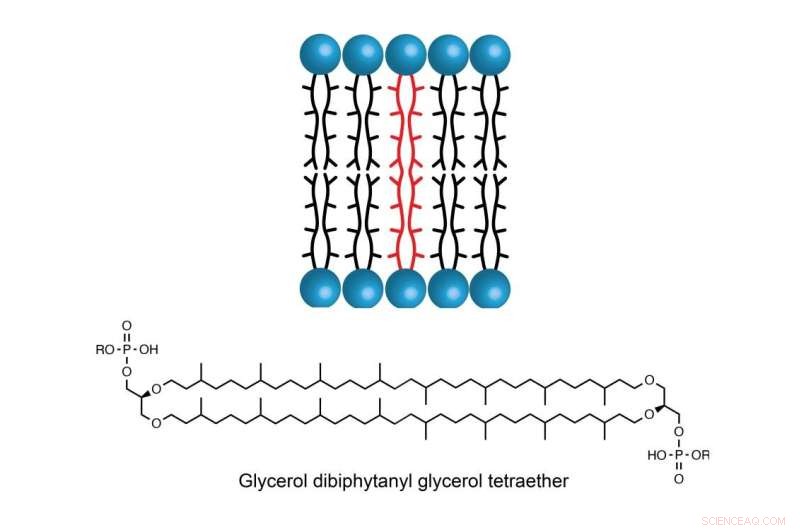
La molecola GDGT si trova nella membrana cellulare di alcune specie di archaea, consentendo agli organismi unicellulari di prosperare in ambienti con temperature, salinità o acidità estremamente elevate. Credito:Booker Lab/Penn State
La stabilità del GDGT è in parte dovuta alle sue due lunghe catene di idrocarburi che si estendono attraverso la membrana. Ma il modo in cui queste due catene si uniscono ha sconcertato gli scienziati per decenni.
"L'accoppiamento dei carboni alla fine delle due catene di idrocarburi è davvero impegnativo per la chimica perché sono inerti, sono chimicamente inattivi", ha affermato Cody Lloyd, uno studente laureato alla Penn State e membro del team di ricerca. "Abbiamo identificato l'enzima che attiva questi carboni terminali e rende possibile questo accoppiamento. Inoltre, ora conosciamo il gene che codifica per questo enzima, che dovrebbe migliorare l'uso del GDGT come indicatore dei climi passati".
L'enzima che facilita l'accoppiamento delle due catene di idrocarburi appartiene a una classe di proteine chiamate proteine radicaliche SAM, che sono note per svolgere un ruolo importante in una varietà di reazioni chimiche, tra cui la produzione di antibiotici, la modifica di proteine, DNA e RNA e la creazione di varie biomolecole.
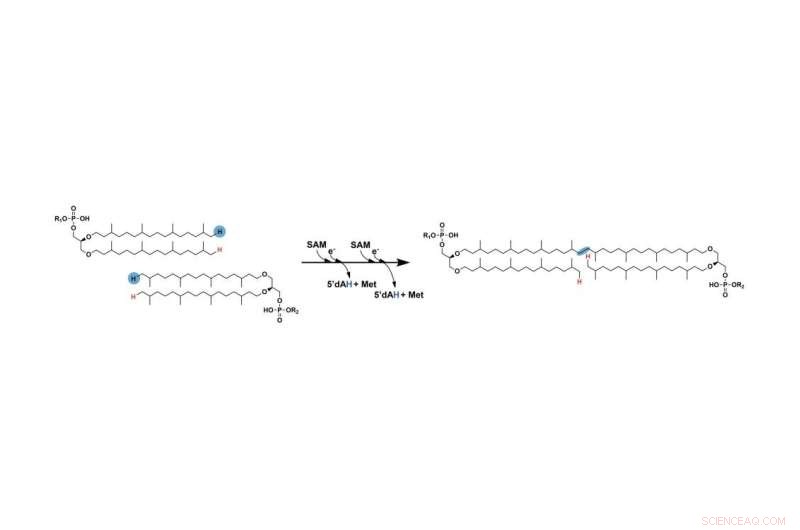
Il passaggio precedentemente mancante nella formazione del GDGT prevede il collegamento di due lunghe catene di idrocarburi. I due idrogeni contrassegnati in blu vengono infine rimossi e le catene alla fine si collegano nei punti in cui quegli atomi sono stati rimossi. Un enzima SAM radicale facilita questo processo. Credito:Booker Lab/Penn State
Il primo passaggio è simile a quello di altre reazioni che coinvolgono gli enzimi SAM radicali:l'enzima SAM radicale utilizza uno dei suoi cluster ferro-zolfo per scindere una molecola chiamata S-adenosil-L-metionina (SAM), producendo un "radicale libero" o un elettrone spaiato che è altamente reattivo e aiuta a far avanzare la reazione. Quindi, il radicale strappa un atomo di idrogeno dal carbonio all'estremità della catena. In una fase successiva, questo processo si ripete con la seconda catena utilizzando una seconda molecola di SAM.
"In definitiva, i carboni alla fine di ciascuna delle catene finiscono per legarsi l'un l'altro nella posizione in cui sono stati rimossi gli atomi di idrogeno", ha detto Lloyd. "Ma una volta che l'idrogeno sulla prima catena viene rimosso, diventa così instabile che potrebbe reagire praticamente con qualsiasi cosa. Per impedire temporaneamente alla prima catena di reagire con qualsiasi obiettivo fuori bersaglio, il carbonio si lega a un atomo di zolfo di un altro di i tre cluster ferro-zolfo dell'enzima."
Una volta che l'idrogeno è stato rimosso dalla seconda catena, il radicale risultante incoraggia la prima catena a rimuoversi dal cluster ferro-zolfo sull'enzima e invece a legarsi alla seconda catena. Ciò fa sì che le due catene vengano legate insieme, completando il passaggio mancante nella formazione del GDGT. I ricercatori presentano i loro risultati in un articolo pubblicato online e stampato nel numero del 1° settembre della rivista Nature .
"Questo è un uso completamente nuovo di un cluster ferro-zolfo, e questo è il primo esempio in natura dell'accoppiamento di due atomi di carbonio completamente inerti con questa configurazione elettronica, che i chimici chiamano sp3 ibridata", ha detto Booker. "C'è stato molto interesse nel creare questo tipo di legami carbonio-carbonio da carboni ibridati sp3 come parte di prodotti farmaceutici e altri prodotti industriali. La natura ha avuto milioni di anni per capire queste cose, quindi continuiamo a guardare alla natura per l'ispirazione per reazioni sintetiche, come questo nuovo uso di un cluster ferro-zolfo". + Esplora ulteriormente