
Figura 1. Una nuova tecnica per l'osservazione delle membrane cellulari viventi per l'AFM utilizzando la membrana porosa di nitruro di silicio (MPM). (a) L'aspetto di MPM. (b) I fori di MPM osservati da AFM. (c) L'MPM quando è posizionato nella camera di osservazione. (d) Schema dell'osservazione della superficie cellulare AFM utilizzando MPM. Credito:Università di Kanazawa
I ricercatori dell'Università di Kanazawa riferiscono in Biologia delle comunicazioni che l'uso di sostanze chimiche comuni per fissare campioni di cellule viventi per studi di microscopia provoca l'aggregazione delle proteine di membrana.
Per le indagini istologiche dei tessuti biologici, ovvero gli studi anatomici al microscopio, i campioni vengono solitamente fissati per impedirne la decomposizione. La fissazione viene in genere eseguita immergendo o perfondendo il campione in una sostanza chimica:aldeidi e alcoli sono fissativi comuni. È stato ipotizzato che le proteine di membrana che si muovono in una certa misura su una membrana cellulare possano formare aggregati durante la fissazione. Tuttavia, sono necessari studi dettagliati sulla superficie cellulare con risoluzione su scala nanometrica per ottenere informazioni definitive su questo potenziale problema. Ora, Takehiko Ichikawa e colleghi dell'Università di Kanazawa hanno condotto studi di microscopia a forza atomica (AFM) sulle superfici cellulari dei mammiferi viventi. Confrontando campioni non fissati e fissati, hanno scoperto che la fissazione porta effettivamente a cambiamenti strutturali.
I ricercatori hanno sviluppato un metodo per utilizzare la membrana microporosa di nitruro di silicio (MPM), utilizzata nella microscopia elettronica a trasmissione (Figura 1), per l'imaging AFM. È importante sottolineare che MPM può rendere piatta la superficie cellulare e prevenire le fluttuazioni supportando l'area al di fuori dell'area di osservazione. Nelle immagini AFM delle superfici delle cellule tumorali del colon in coltura su MPM, le strutture biomolecolari sulle membrane cellulari si sono presentate come sporgenze con una dimensione tipica di pochi nanometri (Figura 2 superficie della cellula vivente).
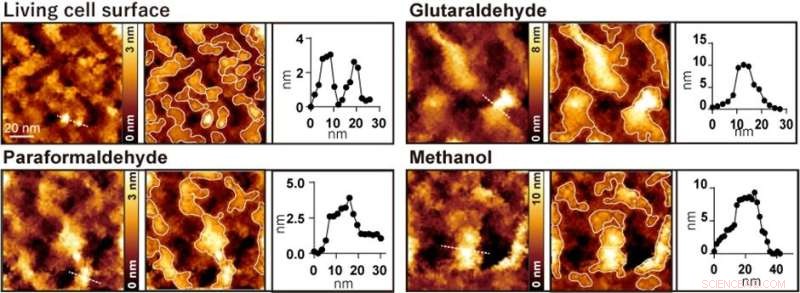
Figura 2. Osservazione della superficie cellulare AFM prima e dopo il trattamento rispettivamente con glutaraldeide, paraformaldeide e metanolo. L'immagine a sinistra è un'immagine AFM, l'immagine centrale è un'immagine AFM con le sporgenze incorniciate e l'immagine a destra è un profilo di altezza lungo la linea tratteggiata nell'immagine a sinistra. Credito:Università di Kanazawa
Quando le cellule sono state trattate con fissativi comunemente usati come paraformaldeide, glutaraldeide e metanolo, alcune strutture nanometriche sono scomparse e sono state osservate solo grandi sporgenze con diametri compresi tra 20 e 100 nanometri (Figura 2). I ricercatori hanno eseguito diversi esperimenti di fluorescenza e hanno concluso che le grandi sporgenze osservate dopo la fissazione erano formate dall'aggregazione di proteine di membrana.
Lo studio dimostra che gli aggregati osservati sono artefatti risultanti dal processo di fissazione. Ciò dovrebbe richiedere cautela nella comunità di ricercatori che lavorano con fissativi chimici. Citando Ichikawa e colleghi:"I ricercatori che osservano i cluster su nanoscala dovrebbero anche prestare attenzione nell'interpretare i loro risultati sperimentali quando utilizzano cellule fisse. Raccomandiamo ai ricercatori di utilizzare il più possibile cellule viventi per evitare l'effetto della fissazione quando studiano i cluster su nanoscala".
Il principio generale alla base della microscopia a forza atomica (AFM) è di eseguire la scansione della superficie di un campione con una punta molto piccola. Durante questa scansione orizzontale (xy), la punta, che è attaccata a un piccolo cantilever, segue il profilo verticale (z) del campione, inducendo una forza sul cantilever che può essere misurata. L'entità della forza nella posizione xy può essere correlata al valore z; i dati xyz generati durante una scansione risultano quindi in una mappa dell'altezza che fornisce informazioni strutturali sul campione indagato. L'AFM non è influenzato dal limite di diffrazione dovuto all'uso di fasci di luce o di elettroni e può osservare la topografia superficiale intatta ad alta risoluzione. + Esplora ulteriormente