Astratto grafico. Credito:Chimica della natura (2022). DOI:10.1038/s41557-022-00937-w
Ogni momento nelle cellule del nostro corpo, grazie agli enzimi, avvengono innumerevoli attività vitali per la vita. Queste speciali proteine agiscono come catalizzatori accelerando il ritmo e migliorando la selettività delle reazioni chimiche senza subire esse stesse modifiche permanenti. Oltre al loro ruolo indispensabile in biologia, gli enzimi sono anche fondamentali per una miriade di processi nell'industria alimentare, farmaceutica, agricola e cosmetica.
Smentendo la loro ubiquità e importanza, gli enzimi sono poco conosciuti. In particolare, gli scienziati vogliono sapere cosa rende i siti attivi degli enzimi, la regione simile a una tasca in cui hanno luogo le reazioni chimiche accelerate, così potenti. Mentre le strutture atomiche tridimensionali dei siti attivi di molti enzimi sono state visualizzate e mappate, la struttura "invisibile" dei campi elettrici all'interno di un sito attivo è per lo più sconosciuta. Si ipotizza che quei campi elettrici svolgano un ruolo importante nella formazione di un ambiente preciso in siti attivi in cui le molecole reagiscono e passano rapidamente a nuove molecole.
Ora uno studio guidato dai ricercatori di Stanford Chu Zheng e Yuezhi Mao ha presentato una nuova sonda per misurare e visualizzare i campi elettrici all'interno del sito attivo di un enzima. L'articolo, recentemente pubblicato sulla rivista Nature Chemistry , riferisce sull'orientamento dei campi elettrici nel sito della reazione e potrebbe aiutare i ricercatori a calcolare le interazioni chimiche chiave nei siti attivi. Queste intuizioni, a loro volta, potrebbero portare alla creazione di enzimi sintetici su misura per l'industria, oltre a promuovere notevolmente la scoperta e la progettazione di nuovi farmaci che interferiscono o modulano la funzione degli enzimi target.
"Abbiamo sviluppato una nuova sonda che può fornirci informazioni importanti su come i campi elettrici sono orientati in modo univoco negli enzimi, che riteniamo sia fondamentale per lo straordinario potere catalitico degli enzimi", ha affermato Zheng, uno studente laureato nel laboratorio di Steven G. Boxer, la professoressa di chimica Camille Dreyfus.
"A livello di base, stiamo cercando di capire meglio come funzionano gli enzimi e, in questo studio, stiamo aggiungendo una nuova dimensione introducendo orientamenti del campo elettrico che si ritiene abbiano un impatto critico sulle funzioni catalitiche dell'enzima", ha affermato Mao, uno studioso post-dottorato in chimica che lavora nel laboratorio di Thomas Markland, professore associato di chimica a Stanford e anche coautore senior.
Un nuovo potente strumento
Il laboratorio Boxer di Stanford ha aperto la strada al concetto di interpretare la funzionalità degli enzimi misurando le interazioni elettrostatiche, che sono presenti in tutte le forme di materia e sono specificamente organizzate in tre dimensioni in grandi molecole biologiche.
"L'origine della straordinaria funzionalità degli enzimi è una questione generale e si applica non solo alla catalisi biologica, ma anche alla catalisi chimica, il che è un business enorme", ha affermato Boxer. "Circa l'80 percento di tutte le sostanze chimiche è prodotto utilizzando catalizzatori, ma ciò che è effettivamente responsabile dell'abbassamento dell'energia libera di attivazione [per far sì che la reazione avvenga più velocemente] non è ben compreso per la maggior parte delle reazioni. Indagare il ruolo dei campi elettrici nella funzione enzimatica è molto molto al centro del nostro lavoro", ha affermato Boxer, presidente del Dipartimento di Chimica della Stanford's School of Humanities and Sciences e coautore senior dello studio.
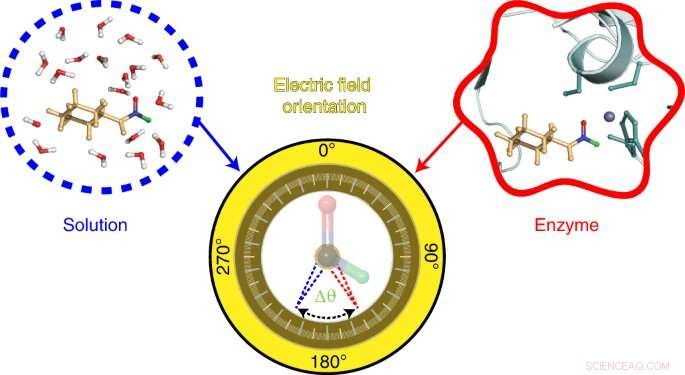
La sonda sviluppata dal team di Stanford si basa su una tecnica, anch'essa sviluppata nel laboratorio Boxer, chiamata spettroscopia vibrazionale dell'effetto Stark. Questa tecnica misura le frequenze vibrazionali nelle molecole della sonda in base alla lunghezza d'onda della luce infrarossa assorbita dai suoi legami chimici. I cambiamenti in queste frequenze vibrazionali rivelano informazioni sui campi elettrici presenti. In questo studio, i ricercatori hanno studiato i cambiamenti nelle frequenze vibrazionali dei legami chimici in una sonda composta da una molecola chiamata N-cicloesilformammide. Questa molecola agisce come un inibitore, legandosi al sito attivo di un enzima chiamato alcol deidrogenasi epatica.
To visualize the electric field in the active site of liver alcohol dehydrogenase, the researchers targeted two bonds in the N-cyclohexylformamide probe about 120 degrees away from each other. That specific angle between the two bonds allowed the researchers to gauge not only the strength, or magnitude, of the electric field, but also the field's orientation. Previous studies from the Boxer lab on other enzyme active sites had reported on the magnitude of electric fields but not on their directions.
"We call this tool a two-directional probe because with this probe we can measure the electric field in an active site in two different directions," Zheng said. "Using the probe this way, we can reconstruct and extract the orientation information about the electric field. That hasn't been done in the past."
Gathering this key measurement first required some chemical sleight of hand. One of the N-cyclohexylformamide probe's chemical bonds—between a carbon atom and a hydrogen atom—is notoriously difficult to observe in protein environments. So, the researchers swapped the hydrogen atom for the element's heavier cousin, called deuterium. The new carbon–deuterium bond proved amenable to measurement, and helped the researchers reveal the orientation of the electric field.
A precise enzymatic environment
The Stanford researchers combined their experimental data with computer simulations and quantum mechanical calculations to describe the electric field's interactions with N-cyclohexylformamide, modified with deuterium, at the active site of liver alcohol dehydrogenase. Those properties were then compared to the electric fields found in water, acetone, and other common solvents.
Notably, the researchers found the orientation of the electric field in the active site of liver alcohol dehydrogenase differs considerably from the electric field orientation in the solvents they studied. That result supports the idea that enzyme active sites feature what scientists call a preorganized electrostatic environment, or one in which the precise positioning of amino acids and the electrostatic environment they create help reduce the energy required for a chemical reaction to take place. This could be a key to enzymes' remarkable ability to catalyze reactions.
"With this study, we are helping to advance the concept of correlating the performance of enzymes with both the magnitude and orientation of the electric fields in active sites," Mao said. "What we have found is evidence that electric fields in the enzyme active sites are preorganized, and that is an important clue in solving the mystery of why enzymes have their amazing abilities."
The probe developed by the Stanford researchers could be used to investigate many other enzymes' active sites. Broadening knowledge in this way will bring scientists and engineers closer to being able to design bespoke enzymes with spectacular new characteristics.
"The ultimate goal of this research is to enable us to design enzymes that have superb catalytic performance for biomedical and industrial application," Zheng said. "We are still far from that, but we are making progress and have a better understanding now than before regarding how enzymes work." + Esplora ulteriormente