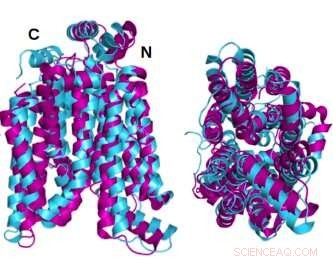
Due angoli della struttura cristallina GLUT1 (magenta) proteina trasportatrice del glucosio sovrapposta alla variante idrosolubile della stessa proteina (ciano) stimata dal computer AlphaFold2 dimostrano che la proteina cristallina e la sua variante QTY solubile in acqua condividono una notevole somiglianza strutturale. Credito:Laboratorio Shuguang Zhang, MIT
Tutte le membrane cellulari del corpo umano hanno proteine incorporate che fungono da sensori, messaggeri o come mezzo di trasporto e regolazione delle sostanze che entrano ed escono dalla cellula. Le proteine di trasporto in particolare sono poco conosciute a causa della loro complessità strutturale e della loro natura idrofobica che le rende resistenti allo studio. Allo stesso tempo, queste proteine di trasporto, in particolare quelle che regolano il glucosio, svolgono un ruolo fondamentale nella crescita dei tumori cancerosi.
In un nuovo studio, gli scienziati guidati dal dottor Shuguang Zhang, Ph.D. del MIT Media Lab, dimostrare un metodo per prevedere rapidamente la progettazione di strutture varianti idrofile delle 14 proteine della membrana di trasporto del glucosio nelle cellule. Ciò consentirà ai ricercatori di studiare più facilmente le proteine nell'acqua. Gli scienziati confermano l'accuratezza delle strutture previste confrontandole con immagini cristallografiche preesistenti di due delle proteine.
Sperano che una migliore comprensione di queste proteine di trasporto del glucosio accelererà lo sviluppo di anticorpi monoclonali terapeutici per il trattamento delle metastasi del cancro. Ciò essenzialmente farebbe morire di fame le cellule tumorali bloccando i trasportatori del glucosio.
"La maggior parte delle cellule tumorali aumenta significativamente la propria espressione e produzione di trasportatori del glucosio, chiamati GLUT, per la loro insaziabile richiesta di energia", afferma Eva Smorodina, una studentessa stagista universitaria in biologia strutturale presso il Greiff Lab, Università di Oslo, che è la prima autrice di un articolo sullo studio pubblicato il 27 giugno su QRB Discovery . "Attualmente non ci sono quasi farmaci efficaci per bloccare i GLUT, poiché hanno una struttura impegnativa."
Le complesse strutture dei GLUT comprendono 12 eliche idrofobiche transmembrana incorporate nella membrana. Nel loro stato nativo o cristallino, le strutture idrofobiche devono essere poste in uno speciale detergente o reagente per lo studio di laboratorio, altrimenti perdono la loro struttura. E con le proteine, struttura e funzione sono indelebilmente correlate.
"Studiare queste proteine nel detersivo è come indossare guanti pesanti per assemblare un costoso orologio o suonare un violino", afferma il dottor Zhang, uno dei pochi scienziati biomedici per i quali lo studio delle proteine di membrana è tanto avvincente quanto vitale per la nostra comprensione delle cellule tumorali. Ha iniziato a lavorare sulle proteine di membrana nei primi anni 2000. "Poche persone stavano studiando queste proteine di membrana", afferma il dottor Zhang. "Sono come una patata bollente", dice, a causa della loro intrinseca resistenza allo studio.
Il nuovo lavoro si basa sul successo del Dr. Zhang quattro anni fa, quando lui e un team hanno realizzato ciò su cui il Dr. Zhang aveva lavorato per quasi un decennio:hanno progettato un metodo meravigliosamente semplice chiamato codice QTY per trasformare una proteina idrofobica della membrana cellulare in una proteina idrofila sostituendo molti aminoacidi idrofobici.
Il codice QTY prende il nome dai simboli dei tre amminoacidi - glutammina (Q), treonina (T) e tirosina (Y) - che sono sostituiti da quattro amminoacidi idrofobici:leucina (L), isoleucina (I), valina ( V) e fenilalanina (F). Nessuno di questi amminoacidi porta una carica, il che rende la sostituzione benigna. La struttura è essenziale per il funzionamento delle proteine e la sostituzione non altera la struttura.
Nell'ultimo studio, il dottor Zhang e il team applicano il codice QTY alle 14 proteine della membrana di trasporto del glucosio che trasportano lo zucchero alle cellule. Hanno utilizzato il nuovo programma AlphaFold2, un programma computazionale basato sull'intelligenza artificiale sviluppato dalla società DeepMind, in grado di prevedere in modo accurato e rapido come si ripiegano le proteine. Il dottor Zhang e il team hanno utilizzato il codice QTY con AlphaFold2 open source per prevedere le forme alfa elicoidali delle 14 proteine GLUT sia nelle loro forme idrofobiche naturali che nelle loro forme idrosolubili alterate dal codice QTY.
Le strutture dello stato cristallino o nativo di due dei GLUT, 1 e 3, erano state rivelate in precedenza da altri ricercatori utilizzando la cristallografia a raggi X. Per avvalorare la propria metodologia, il team del Dr. Zhang ha prima predetto la struttura idrofila di quei due GLUT applicando le sostituzioni degli aminoacidi del codice QTY e lasciando che AlphaFold2 predicesse le forme delle proteine. Lo ha fatto con grande precisione. Le immagini idrofobiche e idrofile sovrapposte sono quasi identiche.
Il team ha seguito questa conferma combinando il codice QTY e AlphaFold2 per prevedere le strutture idrofile degli altri 12 GLUT, a tempo di record. "Nel 2018, ci sono volute dalle quattro alle cinque settimane utilizzando un cluster di computer ad alta velocità per simulare qualsiasi struttura proteica", afferma il dott. Zhang. "Ora con AlphaFold2 possiamo utilizzare gratuitamente un computer Google che simula le proteine transmembrana in poche ore. Alcune piccole proteine hanno impiegato meno di un'ora."
"Questo studio sui trasportatori di glucosio della membrana umana e sulle loro varianti QTY idrosolubili dal laboratorio Zhang del MIT è affascinante", afferma il professor Joel Sussman del Weizmann Institute of Science di Rehovot, in Israele, che non è stato coinvolto nel lavoro. "Fornisce una visualizzazione sperimentale tramite cristallografia a raggi X e previsione dell'IA utilizzando AlphaFold2 per vedere, per la prima volta, a risoluzione atomica, le differenze tra le eliche idrofobiche che odiano l'acqua e le eliche idrofile che amano l'acqua. È un aspetto critico fare un passo nell'utilizzo del metodo del codice QTY per studiare le proteine transmembrana multispan e altre proteine aggregate attraverso le loro varianti idrosolubili, ed è probabile che abbia un enorme impatto nel campo della biotecnologia".
Il professor Robert Langer del MIT, il cui lavoro nell'ingegneria biomedica è molto apprezzato, afferma:"The [QRB Discovery ] il documento è eccellente e credo abbia il potenziale per aiutare molti malati di cancro." Il professor Langer non è stato coinvolto nella ricerca.
Autori della Scoperta QRB carta sono il dottor Zhang e Smorodina; Fei Tao e Rui Qing dell'Università Jiaotong di Shanghai (il dottor Qing è stato in precedenza ricercatore post-dottorato nel MIT Media Lab e successivamente ricercatore presso il Koch Institute for Integrative Cancer Research al MIT); il Dr. Steve Yang, un alunno del MIT ora al PT Metiska Farma in Indonesia; e il dottor David Jin, MD, Ph.D. di Avalon GloboCare Corp., che ha stimolato il Dr. Zhang ad applicare il codice QTY allo studio delle cellule tumorali. Anche Avalon GloboCare ha finanziato la ricerca.
Il dottor Jin dice di sperare, ma questo non fa parte dello studio attuale, che la ricerca futura sarà in grado di alterare geneticamente le membrane del passaggio del glucosio per sviluppare nuovi bersagli terapeutici.
"Ora le nostre uniche scelte per il trattamento del cancro sono la chirurgia, la chemioterapia o la terapia con piccole molecole", afferma il dottor Jin. "In futuro, potrebbe essere possibile prendere la cellula T di un paziente, un componente del sistema immunitario, e modificarla geneticamente in laboratorio in modo che possa funzionare quasi come un sistema GPS per la ricerca del cancro con una capacità di attacco del tumore. " + Esplora ulteriormente