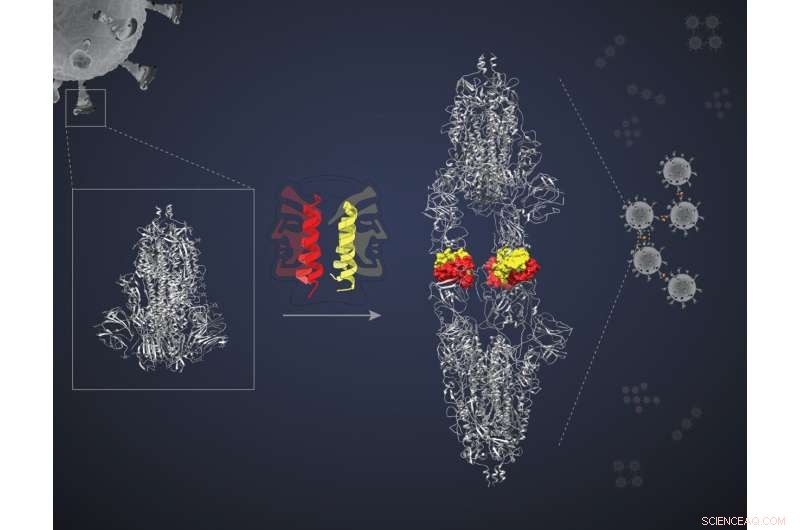
Dimerizzazione della proteina spike da parte del "peptide a due facce". Credito:Bhavesh Khatri
La rapida comparsa di nuovi ceppi del virus SARS-CoV-2 ha ridotto la protezione offerta dai vaccini COVID-19. Un nuovo approccio sviluppato dai ricercatori dell'Indian Institute of Science (IISc) fornisce ora un meccanismo alternativo per rendere inattivi virus come SARS-CoV-2.
In uno studio pubblicato su Nature Chemical Biology , i ricercatori riportano la progettazione di una nuova classe di peptidi artificiali o miniproteine che non solo possono bloccare l'ingresso del virus nelle nostre cellule, ma anche aggregare i virioni (particelle virali), riducendo la loro capacità di infettare.
Un'interazione proteina-proteina è spesso come quella di un lucchetto e di una chiave. Questa interazione può essere ostacolata da una miniproteina prodotta in laboratorio che imita, compete con e impedisce alla "chiave" di legarsi alla "serratura" o viceversa.
Nel nuovo studio, il team ha sfruttato questo approccio per progettare miniproteine che possono legarsi e bloccare la proteina spike sulla superficie del virus SARS-CoV-2. Questo legame è stato ulteriormente caratterizzato in modo estensivo dalla microscopia crioelettronica (crio-EM) e altri metodi biofisici.
Queste miniproteine sono peptidi elicoidali a forma di forcina, ciascuno in grado di accoppiarsi con un altro del suo genere, formando quello che è noto come un dimero. Ogni "fascio" dimerico presenta due "facce" per interagire con due molecole bersaglio. I ricercatori hanno ipotizzato che le due facce si legherebbero a due proteine bersaglio separate, bloccandole tutte e quattro in un complesso e bloccando l'azione dei bersagli. "Ma avevamo bisogno di una prova di principio", afferma Jayanta Chatterjee, professore associato presso l'Unità di biofisica molecolare (MBU), IISc, e autore principale dello studio. Il team ha deciso di testare la loro ipotesi utilizzando una delle miniproteine chiamate SIH-5 per mirare all'interazione tra la proteina Spike (S) di SARS-CoV-2 e la proteina ACE2 nelle cellule umane.
La proteina S è un trimero, un complesso di tre polipeptidi identici. Ogni polipeptide contiene un dominio di legame del recettore (RBD) che si lega al recettore ACE2 sulla superficie della cellula ospite. Questa interazione facilita l'ingresso virale nella cellula.
La miniproteina SIH-5 è stata progettata per bloccare il legame dell'RBD all'ACE2 umano. Quando un dimero SIH-5 incontrava una proteina S, una delle sue facce si legava strettamente a uno dei tre RBD sul trimero della proteina S e l'altra faccia si legava a un RBD da una diversa proteina S. Questo "reticolazione" ha permesso alla miniproteina di bloccare entrambe le proteine S contemporaneamente. "Diversi monomeri possono bloccare i loro bersagli", afferma Chatterjee. "[Ma] la reticolazione delle proteine S blocca la loro azione molte volte in modo più efficace. Questo è chiamato effetto avidità".
Sotto cryo-EM, le proteine S prese di mira da SIH-5 sembravano essere attaccate testa a testa. "Ci aspettavamo di vedere un complesso di uno spike trimero con peptidi SIH-5. Ma ho visto una struttura molto più allungata", afferma Somnath Dutta, assistente professore presso MBU e uno degli autori corrispondenti. Dutta e gli altri si resero conto che le proteine spike erano state costrette a formare dimeri e ad accumularsi in complessi con la miniproteina. Questo tipo di aggregazione può inattivare simultaneamente più proteine spike dello stesso virus e persino più particelle virali. "Ho lavorato con anticorpi sollevati contro la proteina spike in precedenza e li ho osservati sotto un cryo-EM. Ma non hanno mai creato dimeri delle punte", afferma Dutta.
La miniproteina è risultata anche termostabile:può essere conservata per mesi a temperatura ambiente senza deteriorarsi.
Il passo successivo è stato chiedere se SIH-5 sarebbe stato utile per prevenire l'infezione da COVID-19.
Per rispondere a questo, il team ha prima testato la miniproteina per la tossicità nelle cellule di mammifero in laboratorio e l'ha trovata sicura. Successivamente, negli esperimenti condotti nel laboratorio di Raghavan Varadarajan, Professore alla MBU, ai criceti è stata somministrata la miniproteina, seguita dall'esposizione a SARS-CoV-2. Questi animali non hanno mostrato perdita di peso e avevano una carica virale notevolmente ridotta, nonché un danno cellulare molto minore nei polmoni, rispetto ai criceti esposti solo al virus.
I ricercatori ritengono che con piccole modifiche e ingegneria peptidica, questa miniproteina prodotta in laboratorio potrebbe inibire anche altre interazioni proteina-proteina. + Esplora ulteriormente