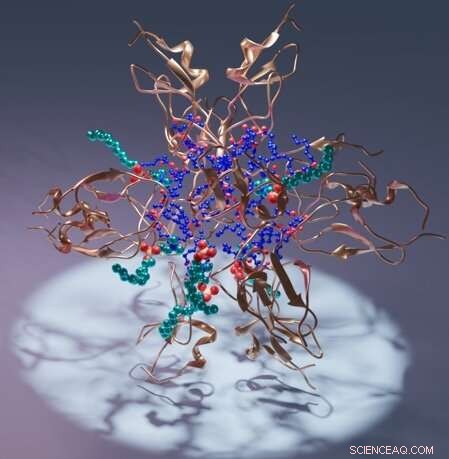
Rappresentazione artistica di un dominio della protein chinasi C C1 (rame), del suo ligando diacilglicerolo (blu) e detergente (ciano). Credito:Sachin Katti.
In un importante progresso per la progettazione razionale di farmaci, un team di Texas A&M AgriLife ha descritto diverse strutture proteiche di un attore cruciale nei processi cellulari. Il progresso potrebbe portare nuove idee per la cura di malattie come l'Alzheimer, l'AIDS, il cancro e altre.
In particolare, il lavoro descrive il dominio C1 della protein chinasi C, PKC, che aiuta a regolare l'attività della proteina negli organismi. Nelle strutture, il dominio C1 avvolge diverse molecole di intenso interesse terapeutico, fornendo la prima guida affidabile a risoluzione atomica per la progettazione di farmaci candidati.
Pubblicato il 16 maggio in Comunicazioni sulla natura , la ricerca è stata diretta da Tatyana Igumenova, Ph.D., professore associato presso il Dipartimento di Biochimica e Biofisica del Texas A&M College of Agriculture and Life Sciences. L'autore principale del progetto è Sachin Katti, Ph.D., un borsista post-dottorato che lavora con Igumenova.
Lo studio ha previsto una collaborazione con Inna Krieger, Ph.D., ricercatore assistente, e James Sacchettini, Ph.D., professore, entrambi nel Dipartimento di Biochimica e Biofisica.
Una delle strutture proteiche più ricercate
Una cellula sana risponde ai segnali chimici in modi precisi e complessi. Ricevere input chimici dall'ambiente cellulare e inoltrarli ai sistemi di controllo centrali all'interno del nucleo cellulare è compito di proteine specializzate come la PKC.
Un'attività PKC impropria si manifesta in molte malattie umane. Di conseguenza, c'è molto interesse nel trovare modi per mettere a punto l'attività PKC con i farmaci. La progettazione di tali farmaci offrirà nuovi approcci per il trattamento del morbo di Alzheimer, dell'AIDS, del cancro e altro ancora.
"La proteina chinasi C è una delle proteine più studiate in biologia cellulare e farmacologia", ha detto Igumenova. "Un ostacolo importante è stata la mancanza di informazioni strutturali precise per guidare gli sforzi di progettazione dei farmaci".
Una complicazione per la progettazione del farmaco è che la famiglia PKC ha 11 membri. Diversi membri della famiglia PKC possono avere effetti fisiologici opposti, quindi un candidato farmaco di successo deve essere selettivo su quale PKC prende di mira.
Per fare ciò, i candidati alla droga devono adattarsi a un PKC target come la chiave di una serratura. Ma determinare la struttura 3D di un PKC "on-switch" - il dominio C1 - legato agli attivatori PKC non è stato facile.
Le strutture proteiche vengono generalmente risolte utilizzando la cristallografia a raggi X. La tecnica prevede l'utilizzo di raggi X per determinare la posizione degli atomi in un cristallo. Per questo metodo, i ricercatori devono creare condizioni in cui la proteina di interesse si cristallizza. Tuttavia, gli intensi sforzi in molti laboratori di ricerca negli ultimi tre decenni non sono riusciti a produrre cristalli di domini C1 legati a ligandi rilevanti. A causa di questa mancanza di progressi, diversi ricercatori hanno dichiarato il compito impossibile, ha detto Igumenova.

Cristalli di un dominio della proteina chinasi C si sono formati spontaneamente nella provetta NMR di Katti. Credito:Sachin Katti.
Risolvere un problema di 30 anni
Accettando il problema come impegnativo, Katti e Igumenova hanno deciso invece di studiare le molecole in soluzione mediante risonanza magnetica nucleare, NMR, spettroscopia. Ciò ha comportato la ricerca dei componenti giusti per imitare le membrane cellulari, dove il dominio C1 avrebbe incontrato ligandi.
"Poi, un bel giorno, Sachin ha scoperto la formazione di cristalli in un vecchio tubo NMR", ha detto Igumenova. "Devo tutto il merito di Sachin, che in pratica ha detto:'Vado a testarli e vedere se sono effettivamente la proteina.' E aveva ragione. Ci ha dato fiducia che la cristallizzazione è possibile."
A sua volta, Katti dà credito alle intuizioni ottenute da NMR e un po' di fortuna.
"Penso che sia il bello di fare ricerche in cui devi usare più approcci", ha detto. "Non sai mai quando un approccio sarà utile per fare qualcosa con altri approcci."
Informazioni da NMR e cristallografia a raggi X
Le nuove strutture proteiche, insieme ai risultati NMR del team, hanno già fornito informazioni interessanti. Un mistero di vecchia data è stato come i domini C1 possano ospitare ligandi che hanno strutture chimiche molto diverse, ha detto Igumenova.
"Il nostro precedente lavoro NMR ha indicato che i loop del dominio C1 che legano i ligandi sono molto dinamici", ha detto Igumenova. "Questo dominio C1 è come un PAC-man. Si lega alla membrana e poi cerca un ligando. Una volta trovato il ligando, si aggancia."
Inoltre, la struttura mostra che il solco di legame del ligando ha una superficie "amante dell'acqua" o idrofila nella parte inferiore e una superficie "idrorepellente" o idrofobica nella parte superiore.
"Se pensi a una molecola lipidica, il gruppo della testa è idrofilo e la coda è idrofoba", ha detto Igumenova. "Quindi, quando i domini C1 legano i ligandi lipidici, i modelli corrispondono."
I risultati del team includono la struttura di un dominio C1 legato al suo ligando naturale, il diacilglicerolo. Inoltre, il team descrive diverse altre strutture di C1 che includono diversi composti di interesse farmacologico.
Il lavoro fornisce anche un metodo per testare diversi farmaci candidati, ha affermato Katti.
"Se vuoi studiare i pesci, vuoi studiarli nell'acqua", ha detto Katti. "Ora sappiamo come creare un ambiente simile a una membrana in cui questi composti molto idrofobici possono essere testati per il legame C1."
Successivamente, Katti e Igumenova hanno in programma di esplorare i domini C1 di altri membri della famiglia PKC.
"È importante per noi concentrarci sui domini C1 perché hanno differenze intrinseche che possono essere sfruttate per ottenere la selettività", ha affermato Igumenova. "Quello che stiamo scoprendo ora è che non tutti i domini C1 sono creati uguali". + Esplora ulteriormente