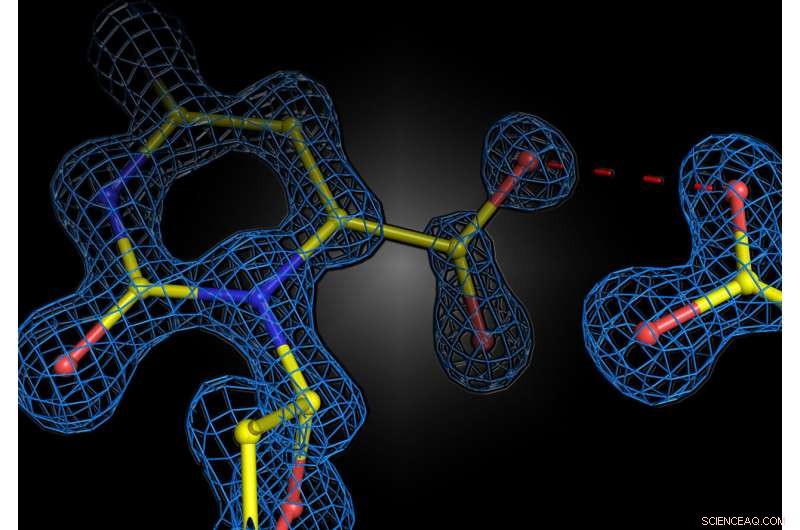
Istantanea strutturale della reazione enzimatica nell'enzima umano orotidina 5'-fosfato decarbossilasi. Le due cariche negative del substrato e dell'enzima non si respingono, ma formano un'interazione attraente. Credito:Kai Tittmann
È noto in fisica e chimica che cariche uguali si respingono, mentre cariche opposte si attraggono. Per molto tempo si è ritenuto che questo principio si applichi anche quando gli enzimi, i catalizzatori biologici in tutti gli organismi viventi, formano o rompono legami chimici. Si pensava che gli enzimi collocassero cariche nei loro "centri attivi", dove effettivamente hanno luogo le reazioni chimiche, in modo tale da respingere cariche simili dalle altre molecole che li circondano. Questo concetto è noto come "stress elettrostatico". Ad esempio, se il substrato (la sostanza su cui agisce l'enzima) porta una carica negativa, l'enzima potrebbe utilizzare una carica negativa per "stressare" il substrato e quindi facilitare la reazione. Tuttavia, un nuovo studio dell'Università di Gottinga e dell'Istituto Max Planck per le scienze multidisciplinari di Gottinga ha ora dimostrato che, contrariamente alle aspettative, due cariche uguali non portano necessariamente alla repulsione, ma possono causare attrazione negli enzimi. I risultati sono stati pubblicati sulla rivista Nature Catalysis .
Il team ha studiato un noto enzima che è stato ampiamente studiato ed è un esempio da manuale di catalisi enzimatica. Senza l'enzima, la reazione è estremamente lenta:ci vorrebbero infatti 78 milioni di anni prima che metà del substrato reagisca. L'enzima accelera questa reazione di 10 17 volte, semplicemente posizionando cariche negative e positive nel centro attivo. Poiché il substrato contiene un gruppo caricato negativamente che viene scisso come anidride carbonica, per decenni si è ritenuto che le cariche negative dell'enzima servissero a sollecitare il substrato, anch'esso caricato negativamente, e ad accelerare la reazione. Tuttavia, questo ipotetico meccanismo non è stato dimostrato perché la struttura della reazione era troppo veloce per essere osservata.
Il gruppo del professor Kai Tittmann presso il Göttingen Center for Molecular Biosciences (GZMB) è ora riuscito per la prima volta a utilizzare la cristallografia proteica per ottenere un'istantanea strutturale del substrato poco prima della reazione chimica. Inaspettatamente, le cariche negative dell'enzima e del substrato non si respinsero a vicenda. Invece, hanno condiviso un protone, che ha agito come una sorta di colla molecolare in un'interazione attraente. "La questione se due cariche uguali siano amiche o nemiche nel contesto della catalisi enzimatica è stata a lungo controversa nel nostro campo e il nostro studio mostra che i principi di base del funzionamento degli enzimi sono ancora lontani dall'essere compresi", afferma Tittmann . Le strutture cristallografiche sono state analizzate dal professor Ricardo Mata, chimico quantistico, e dal suo team dell'Istituto di chimica fisica dell'Università di Göttingen. "Il protone aggiuntivo, che ha una carica positiva, tra le due cariche negative non viene solo utilizzato per attrarre la molecola coinvolta nella reazione, ma innesca una cascata di reazioni di trasferimento di protoni che accelerano ulteriormente la reazione", spiega Mata.
"Riteniamo che questi principi appena descritti della catalisi enzimatica aiuteranno nello sviluppo di nuovi catalizzatori chimici", afferma Tittmann. "Poiché l'enzima che abbiamo studiato rilascia anidride carbonica, il più importante gas serra prodotto dalle attività umane, i nostri risultati potrebbero aiutare a sviluppare nuove strategie chimiche per la fissazione dell'anidride carbonica". + Esplora ulteriormente