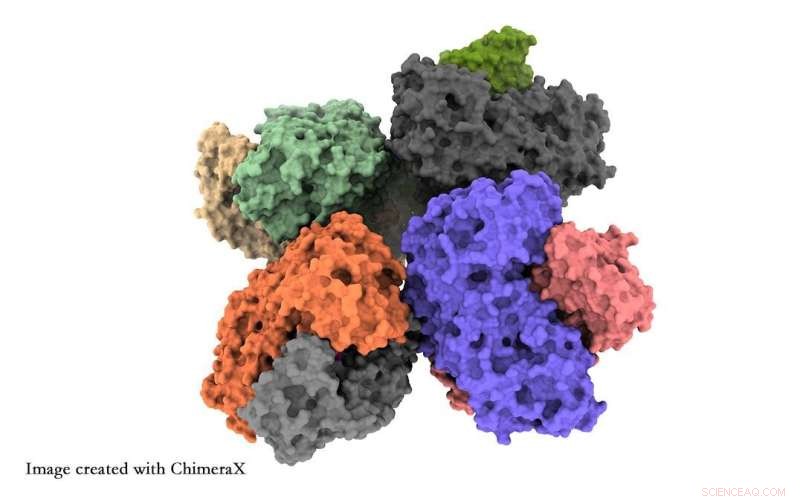
I ricercatori dell'Università di Tsukuba hanno ottenuto approfondimenti a livello atomico sulla struttura dell'enzima fosfochetolasi, che aiuterà i ricercatori a ottimizzare questo enzima per la sintesi di materie prime chimiche. Credito:Università di Tsukuba
I prodotti farmaceutici, della plastica e di altri settori utilizzano enzimi per aiutare a sintetizzare materie prime molecolari. Gli enzimi presi direttamente da microbi come i batteri spesso non sono ottimali per l'uso industriale; un problema è che spesso non sopravvivono alle temperature elevate che accelerano una sintesi. L'ingegneria genetica può aiutare a personalizzare gli enzimi per questi scopi. La conoscenza dell'esatta struttura atomo per atomo dell'enzima originale è importante per comprendere la funzione dell'enzima in natura, fornendo così informazioni su come ottimizzare l'ingegneria genetica degli enzimi. Tuttavia, la cristallografia a raggi X, una tecnica comune per determinare la struttura di un enzima come fase critica in questo processo, può purtroppo alterarne anche la struttura.
Una tecnica nota come microscopia elettronica criogenica (crio-EM) può fornire un livello di dettaglio strutturale simile a quello della cristallografia a raggi X pur mantenendo la struttura dell'enzima nativo. Infatti, il Premio Nobel per la Chimica 2017 è stato assegnato per aver utilizzato questa tecnica per determinare la struttura delle molecole biologiche. Ora, in uno studio recentemente pubblicato sul Journal of Structural Biology , ricercatori dell'Università di Tsukuba e partner di collaborazione hanno utilizzato la crio-EM per determinare la struttura dell'enzima di fermentazione fosfochetolasi. Questo lavoro faciliterà l'ingegneria genetica dell'enzima per le sintesi industriali.
"La cristallografia a raggi X ha rivoluzionato il modo in cui i ricercatori identificano le strutture proteiche, ma lo sviluppo di mezzi alternativi che riflettano meglio le strutture osservate in biologia sono inestimabili", spiega l'autore senior, il professor Kenji Iwasaki. "Il nostro utilizzo della crio-EM come strumento di imaging ha portato alla luce dettagli strutturali precedentemente oscurati nella fosfochetolasi che andranno a beneficio diretto dell'industria chimica".
I ricercatori riportano due risultati principali. Innanzitutto, otto unità di fosfochetolasi si raggruppano in un'unica struttura, nota come ottamero. In secondo luogo, hanno osservato i dettagli di una catena di aminoacidi nota come ciclo QN che può determinare se il sito funzionale dell'enzima è aperto o chiuso. Questo è un possibile mezzo per aumentare la produzione chimica dell'enzima.
La cristallografia a raggi X oscura i dettagli strutturali forniti dalla crio-EM. L'ottamero era stato precedentemente osservato mediante cristallografia a raggi X, ma si pensava che fosse semplicemente un artefatto di misurazione. Inoltre, la cristallografia a raggi X non rileva i dettagli strutturali aperti/chiusi.
"L'industria sarà ora in grado di correlare la funzione della fosfochetolasi con la sua struttura corretta", afferma Iwasaki. "Ci aspettiamo che queste informazioni ricordino ai ricercatori che la cristallografia a raggi X non è necessariamente l'ultima parola sulla struttura degli enzimi; la crio-EM può offrire preziose informazioni".
I risultati di questo studio sono importanti per ottimizzare le prestazioni di un enzima di fermentazione utile per eseguire sintesi chimiche nell'industria. Utilizzando le intuizioni strutturali degli enzimi per massimizzare il successo dell'ingegneria genetica, è possibile produrre materie prime per prodotti farmaceutici, plastica e altri materiali in modo ambientalmente sostenibile. + Esplora ulteriormente