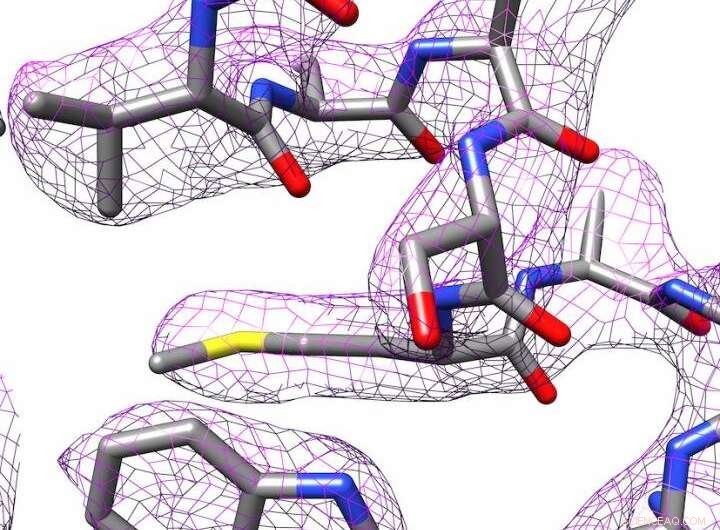
Struttura 3D dell'apoferritina prodotta mediante criomicroscopia elettronica. Credito:Panagiotis Kastritis
I biochimici della Martin Luther University Halle-Wittenberg (MLU) hanno utilizzato un criomicroscopio elettronico standard per ottenere immagini sorprendentemente buone che sono alla pari con quelle scattate da apparecchiature molto più sofisticate. Sono riusciti a determinare la struttura della ferritina quasi a livello atomico. I loro risultati sono stati pubblicati sulla rivista PLOS UNO .
La criomicroscopia elettronica è diventata sempre più importante negli ultimi anni, soprattutto nel fare luce sulle strutture proteiche. Gli sviluppatori della nuova tecnologia hanno ricevuto il premio Nobel per la chimica nel 2017. Il trucco:i campioni vengono congelati e poi bombardati con elettroni. Nel caso della microscopia elettronica tradizionale, tutta l'acqua viene prima estratta dal campione. Ciò è necessario perché l'indagine si svolge nel vuoto, il che significa che l'acqua evaporerebbe immediatamente e renderebbe impossibile l'imaging.
Però, perché le molecole d'acqua svolgono un ruolo così importante nelle biomolecole, soprattutto nelle proteine, non possono essere esaminati utilizzando la microscopia elettronica tradizionale. Le proteine sono tra i più importanti elementi costitutivi delle cellule e svolgono una varietà di compiti. Una conoscenza approfondita della loro struttura è necessaria per capire come funzionano.
Il gruppo di ricerca guidato dal Dr. Panagiotis Kastritis, che è capogruppo presso il Center for Innovation Competence HALOmem e professore junior presso l'Istituto di Biochimica e Biotecnologia della MLU, ha acquisito un criomicroscopio elettronico all'avanguardia nel 2019. "Non c'è nessun altro microscopio simile a Halle, " dice Kastritis. Il nuovo Thermo Fisher Glacios 200 kV, finanziato dal Ministero Federale dell'Istruzione e della Ricerca, non è il microscopio migliore e più costoso del suo genere.
Tuttavia, Kastritis e i suoi colleghi sono riusciti a determinare la struttura dell'apoferritina della proteina di deposito del ferro fino a 2,7 ångströms (Å), in altre parole, quasi fino al singolo atomo. Un ångström equivale a un decimo di nanometro. Questo pone il gruppo di ricerca in una lega simile ai dipartimenti con attrezzature molto più costose. L'apoferritina viene spesso utilizzata come proteina di riferimento per determinare i livelli di prestazione dei microscopi corrispondenti.
Solo recentemente, due gruppi di ricerca hanno battuto un nuovo record con una risoluzione di circa 1.2 . "Tali valori possono essere raggiunti solo utilizzando strumenti molto potenti, che solo una manciata di gruppi di ricerca in tutto il mondo hanno a loro disposizione. Il nostro metodo è progettato per i microscopi presenti in molti laboratori, " spiega Kastritis.
I criomicroscopi elettronici sono dispositivi molto complessi. "Anche piccoli disallineamenti possono rendere inutili le immagini, " dice Kastritis. È importante programmarli correttamente e Halle ha le competenze tecniche per farlo. Ma l'analisi che viene condotta dopo che i dati sono stati raccolti è altrettanto importante. "Il microscopio produce diverse migliaia di immagini, " spiega Kastritis.
I programmi di elaborazione delle immagini vengono utilizzati per creare una struttura 3D della molecola. In collaborazione con il professor Milton T. Stubbs dell'Istituto di biochimica e biotecnologia della MLU, i ricercatori hanno sviluppato un nuovo metodo per creare un modello ad alta risoluzione di una proteina. Il gruppo di ricerca di Stubbs utilizza la cristallografia a raggi X, un'altra tecnica per determinare la struttura delle proteine, che richiede la cristallizzazione delle proteine. Sono stati in grado di combinare una forma modificata di una tecnica di analisi delle immagini con le immagini scattate con il criomicroscopio elettronico. Ciò rendeva visibili gli stati di carica e le singole molecole d'acqua.
"È un metodo attraente, " dice Kastritis. Invece di aver bisogno di microscopi molto costosi, è necessaria molta capacità di calcolo, che ha MLU. Ora, oltre a utilizzare la cristallografia a raggi X, La criomicroscopia elettronica può essere utilizzata per produrre immagini di proteine, specialmente quelle difficili da cristallizzare. Ciò consente la collaborazione, dentro e fuori l'università, sull'analisi strutturale di campioni con potenziale medico e biotecnologico.