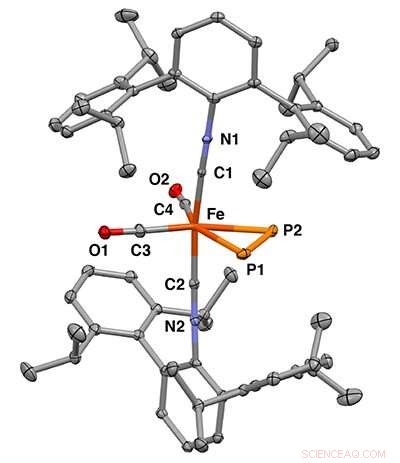
Struttura cristallina a raggi X del complesso mononucleare ferro η2-difosforo. Credito:Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University
Gli elementi sulla tavola periodica degli elementi sono elencati in modi che enfatizzano determinate relazioni. Ci sono famiglie, periodi (le righe orizzontali) e gruppi (le colonne verticali). Gli elementi all'interno di ciascuno di questi raggruppamenti presentano alcuni punti in comune.
Esistono relazioni diagonali nella tavola periodica tra due elementi in posizioni diagonali tra loro che mostrano proprietà chimiche simili. Litio e magnesio, boro e silicio, carbonio e fosforo sono tutti esempi.
Da tempo è stata riconosciuta un'iconica relazione diagonale tra carbonio e fosforo, specialmente nei casi in cui è presente un legame multiplo elemento-elemento, come il difosforo (P2 ) in cui due atomi di fosforo sono uniti da un debole triplo legame.
Questa relazione diagonale tra fosforo e carbonio ha stabilito quell'aspettativa che la molecola di difosforo dovrebbe imitare gli attributi dell'idrocarburo acetilene (C2 H2 ). Ad esempio, sia il difosforo che l'acetilene reagiscono con altre molecole organiche attraverso i loro legami pi, un tipo di legame covalente che si trova nelle molecole con legami multipli.
Un complesso di coordinazione è costituito da un atomo o ione centrale che di solito è metallico ed è circondato da molecole o ioni legati, noti come ligandi o agenti complessanti. I complessi di coordinamento sono vitali per la vita sulla terra e includono emoglobina e clorofilla. Sono anche ampiamente utilizzati in applicazioni industriali come catalizzatori.
Sebbene l'acetilene abbia una chimica di coordinazione ben documentata con singoli metalli di transizione, i complessi di coordinazione che presentano difosforo legato a un singolo centro metallico sono rimasti sfuggenti.
Recentemente ricercatori dell'Università della California a San Diego, dell'Università di Rochester e della Ohio State University hanno riferito di legare il difosforo a un singolo centro di metallo. Questo lavoro appare nel numero del 25 marzo di Scienza .
Il difosforo, a differenza dell'acetilene, è altamente instabile e reattivo. Quando generato in forma libera, il difosforo polimerizza o reagisce rapidamente con le molecole di substrato presenti. In altre parole, il difosforo non rimane difosforo a lungo:la sua natura è combinarsi con altri elementi e molecole. Questo rende difficile studiare o manipolare.
Sono state stabilite diverse vie sintetiche per formare complessi multinucleari di difosforo. Il metodo più popolare è separare il tetraedrico P4 molecola, più comunemente nota come fosforo bianco. Tuttavia, il fosforo bianco è tossico e altamente infiammabile (era un componente principale di molte bombe incendiarie usate durante la seconda guerra mondiale).
"Il lavoro qui presentato fornisce una strategia sintetica per accedere ai complessi mononucleari di difosforo in ambienti di laboratorio", ha affermato Joshua Figueroa, ricercatore principale e coautore dell'articolo, professore di chimica e biochimica della UC San Diego. "Prevediamo che questa modalità di coordinamento possa ulteriormente consentire lo sviluppo di reazioni selettive di trasferimento di atomi di fosforo alle molecole organiche".
Nel progettare l'esperimento, Figueroa e lo studioso post-dottorato dell'UC San Diego Shuai Wang hanno utilizzato il ferro come ione metallico perché forniva una buona piattaforma di coordinamento che consentiva il legame di piccole molecole in modo efficiente. Legando il difosforo a uno ione ferro, sono stati in grado di unire i due atomi di fosforo in un modo che aggirava il rilascio libero di difosforo, fornendo una stabilità molto ricercata.
Wang, che è il primo autore dell'articolo e ha eseguito il lavoro di sintesi, ha detto:"Considerando l'estrema sensibilità della molecola di difosforo libera come specie fugace, è notevole quanto diventi stabile coordinandosi con il centro del ferro mononucleare stericamente ingombrato. "
I ricercatori hanno utilizzato la cristallografia a raggi X per determinare la precisa struttura 3D delle molecole e la spettroscopia Mossbauer per osservare i cambiamenti nelle interazioni di legame tra lo ione ferro e il difosforo. Questa era una tecnica chiave perché ha permesso ai ricercatori di dimostrare che il difosforo e una molecola di acetilene influenzavano le proprietà del centro del ferro in modi simili.
Se il difosforo può esistere in una forma relativamente stabile e selettivamente reattiva, gli scienziati saranno in grado di attaccarlo ai substrati in qualcosa noto come chimica del "clic". La chimica del clic non descrive una singola reazione specifica, ma descrive un modo per generare sostanze unendo piccole unità modulari. Ciò potrebbe aprire nuove aree di scoperta nella chimica sintetica per la preparazione di composti farmaceutici.
"Siamo entusiasti di questo lavoro perché dimostra l'importanza di utilizzare i concetti fondamentali appresi nella chimica del primo anno per guidare nuove scoperte", ha affermato Figueroa. + Esplora ulteriormente