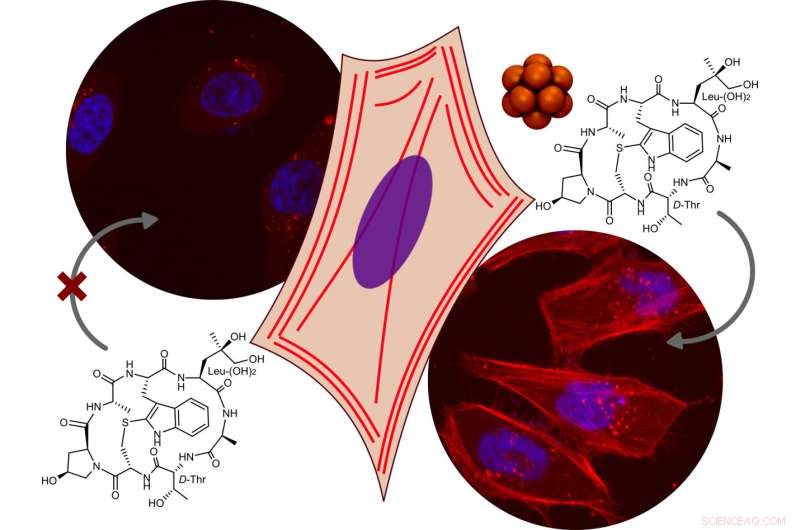
I cluster di boro supercaotropico hanno mostrato attività portante non solo nelle vescicole modello, ma anche nelle cellule viventi. Credito:CiQUS
L'interiorizzazione di molecole impermeabili nelle cellule è una sfida attuale nello sviluppo di farmaci, poiché molte molecole bioattive idrosolubili non possono attraversare la membrana cellulare. Per facilitare l'ingresso cellulare di queste molecole, sono stati ideati trasportatori artificiali, come polimeri, lipidi o peptidi penetranti cationici. Ad oggi, la maggior parte di questi vettori è stata concepita basandosi su una particolare proprietà che permette loro di attraversare il doppio strato lipidico:l'anfifilia. Le molecole anfifiliche possiedono regioni differenziate che consentono loro di interagire con il carico idrosolubile e la membrana lipidica. Tutti i vettori di membrana conosciuti fino ad oggi condividono un'anfifilia molecolare simile che consente loro di interagire con la membrana anfifilica. Tuttavia, questi trasportatori di solito devono affrontare limitazioni dovute alle caratteristiche intrinseche delle molecole anfifiliche, come ad esempio la tossicità associata al loro comportamento simile a un detergente che può danneggiare le membrane cellulari, o la loro tendenza all'aggregazione, che può limitare le concentrazioni alle quali possono essere utili .
Il recente studio pubblicato su Natura dai ricercatori del Center for Research in Biological Chemistry and Molecular Materials (CiQUS, USC), in collaborazione con la Jacobs University (Brema, Germania), presenta una nuova classe di carrier di membrana che lascia il paradigma anfifilico. Questi nuovi vettori sono basati su anioni cluster dodecaborato alogenati, con una forma globulare di appena 24 atomi, che hanno una carica negativa e un'ottima solubilità in acqua. Nonostante la loro carica anionica e l'assenza di domini differenziati, questi cluster presentano anche affinità per le membrane lipidiche a causa della loro natura supercaotropica. Questa proprietà caotropica può essere considerata come una capacità di questi ammassi di disordinare le molecole d'acqua, che ora ha dimostrato di consentire una disidratazione dei carichi idrofili e quindi consentire loro di viaggiare attraverso le membrane idrofobiche.
Questi cluster possono interagire con carichi idrofili senza incapsularli o formare aggregati con essi. Utilizzando vescicole modello, nel gruppo del Prof. Werner Nau (Jacobs University, Brema), è stato riscontrato che il cluster più piccolo e meno caotropico (B12 H12 2– ) era inattivo, mentre quello più grande e caotropico (B12 Io12 2– ) ha interagito troppo fortemente con la membrana lipidica. Tuttavia, i cluster dodecaborati con caotropicità bilanciata, come l'alogenato B12 Cl12 2– e B12 Br12 2– , ha attivato la traslocazione di diversi carichi attraverso il doppio strato lipidico senza distruggere l'integrità della membrana. In particolare, il bromurato B12 Br12 2– è emerso come il candidato ottimale di una nuova classe di portatori di boro supercaotropico. "Questi nuovi vettori mostrano proprietà di trasporto molto distintive", afferma il dott. Andrea Barba-Bon, ricercatore di JU e co-primo autore dello studio. "A differenza dei classici trasportatori anfifilici, la loro attività non è stata influenzata dalla sequenza dell'aggiunta di grappolo e carico alle vescicole o dalla carica di membrana della vescicola".
Con l'eccezione delle molecole caricate negativamente, questo vettore è stato in grado di fornire un'ampia varietà di carichi, che vanno da piccole molecole a peptidi più grandi. Inoltre, i cluster di boro supercaotropico hanno mostrato attività portante non solo nelle vescicole modello, ma anche nelle cellule viventi. I cluster potrebbero trasportare in modo efficiente all'interno delle cellule viventi diverse molecole nelle cellule, come mostrato dal gruppo del Prof. Javier Montenegro (CIQUS, USC). I cluster di boro sono stati in grado di fornire un carico di falloidina completamente funzionale, un peptide ciclico impermeabile tradizionalmente impiegato per etichettare il citoscheletro delle cellule fisse, nel citosol delle cellule viventi e colorare il citoscheletro di actina di diversi tipi cellulari. L'ampio spettro di carichi bioattivi che potevano essere trasportati includeva anche il PROTAC dBET1 a bassa permeabilità o l'antineoplastico monometil auristatina F, che sono stati interiorizzati 2-3 volte in modo più efficiente in presenza del cluster di boro. "Abbiamo identificato una nuova classe di trasportatori che possono essere utilizzati per fornire molte molecole diverse nelle cellule. Gli anioni supercaotropici sono un nuovo strumento per il trasporto di molecole idrofile nelle cellule, il cui potenziale sta solo iniziando a essere esplorato", afferma Giulia Salluce ( CiQUS), dottorato di ricerca studente nel gruppo del Montenegro e co-primo autore dello studio. + Esplora ulteriormente