Gli organismi multicellulari, come gli animali e le piante, hanno cellule complesse con diverse funzioni. Questa complessità deriva dalla necessità che le cellule producano proteine distinte che interagiscono tra loro. Questa interazione è fondamentale affinché le cellule possano svolgere i loro compiti specifici e formare complessi macchinari molecolari.
Tuttavia, la nostra attuale comprensione di tali interazioni proteina-proteina spesso manca di contesti cellulari perché di solito venivano studiate in un sistema in vitro o in cellule isolate dal loro ambiente tissutale. Mancano in gran parte metodi efficaci per studiare le interazioni proteina-proteina in modo tessuto-specifico.
Per colmare questo divario tecnologico, un gruppo di ricerca collaborativo dell'Università di Hong Kong (HKU), guidato dal professor Xiang David Li del Dipartimento di Chimica e dal professor Chaogu Zheng della Scuola di Scienze Biologiche, entrambi della Facoltà di Scienze, insieme a con il dottor Xiucong Bao della Scuola di scienze biomediche, Facoltà di medicina di Li Ka Shing, hanno recentemente sviluppato un nuovo approccio di biologia chimica.
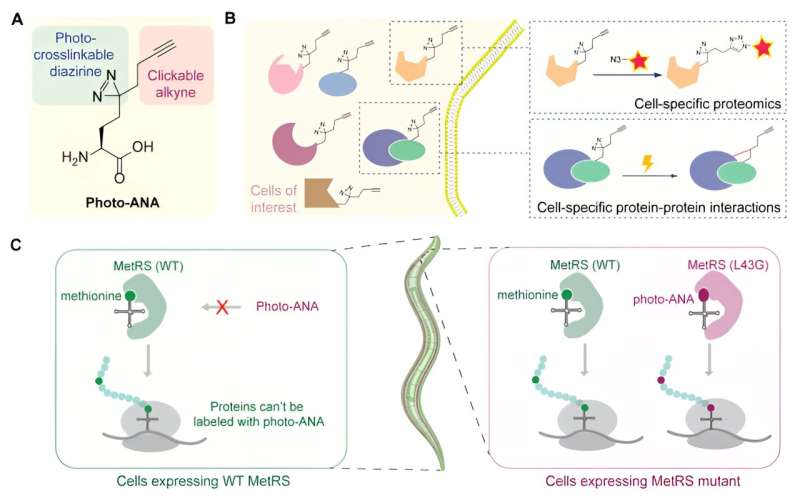
Il team ha etichettato le proteine di cellule specifiche con una sonda di amminoacidi bifunzionale che consente di isolare le proteine marcate e di catturare le interazioni proteina-proteina attraverso la fotoreticolazione.
Questo nuovo metodo, MACSPI (Proteomics and Interactomics specifico per le cellule basato sugli analoghi della metionina), ha permesso al team di identificare molte nuove proteine tessuto-specifiche e interazioni proteiche, aiutandoci a comprendere meglio come funzionano le cellule negli organismi viventi e a studiare vari problemi biologici, come lo sviluppo degli organi e la patogenesi delle malattie.
Il lavoro è stato recentemente pubblicato negli Proceedings of the National Academy of Sciences .
Il team ha progettato e sintetizzato un amminoacido innaturale (foto-ANA) che è strutturalmente simile alla metionina, l'amminoacido presente in natura, ma con due componenti aggiuntivi.
Un componente è un gruppo alchino, che può essere utilizzato come strumento chimico per l'estrazione e la purificazione delle proteine marcate. L'altro è un gruppo diazirina, che può essere attivato dalla luce per creare legami covalenti stabili tra le proteine marcate e le molecole con cui interagiscono.
Successivamente, il team ha progettato un enzima chiamato MetRS per creare una variante in grado di riconoscere e incorporare l’amminoacido innaturale nelle proteine mentre vengono costruite. Controllando l'espressione di questo enzima ingegnerizzato in tessuti specifici, solo le proteine del tessuto di interesse vengono marcate dalla sonda chimica. Inoltre, con la reticolazione indotta dalla luce, è possibile catturare e isolare complessi proteici da tessuti specifici.
Come prova di concetto, il team ha applicato il metodo MACSPI per profilare le proteine rispettivamente delle cellule muscolari e dei neuroni in un organismo modello chiamato C. elegans e ha scoperto molte nuove proteine specifiche del tessuto.
Il team ha anche dimostrato l'utilità del metodo nel catturare l'interazione proteina-proteina tessuto-specifica identificando gli interattori tessuto-specifici di una proteina espressa ubiquitariamente, come lo chaperone molecolare chiamato HSP90. Si è scoperto che HSP90 si lega a gruppi distinti di proteine per regolare diversi processi biologici nei muscoli e nei neuroni.
"Questo studio è un eccellente esempio di come metodi innovativi di etichettatura chimica possano aiutare a risolvere difficili problemi biologici", ha affermato il professor Xiang David Li.
"Comprendere l'interazione proteina-proteina a livello di risoluzione cellulare è spesso fondamentale per decifrare il meccanismo molecolare di un processo patologico. Ad esempio, stiamo attualmente esplorando le funzioni degli interattori neuronali HSP90 che abbiamo identificato; alcuni sembrano essere coinvolti nella neurodegenerazione in un soggetto affetto da Parkinson." modello di malattia", ha affermato il professor Chaogu Zheng.
Il team prevede che il metodo MACSPI possa essere utilizzato in molti organismi multicellulari per profilare proteomi e interattomi con specificità spaziale e temporale, il che può facilitare un ampio spettro di ricerca biologica e biomedica.
Ulteriori informazioni: Siyue Huang et al, MACSPI consente analisi proteomiche e interattomiche tissutali selettive in organismi multicellulari, Atti dell'Accademia nazionale delle scienze (2024). DOI:10.1073/pnas.2319060121
Informazioni sul giornale: Atti dell'Accademia Nazionale delle Scienze
Fornito dall'Università di Hong Kong