La pandemia di COVID-19 ha provocato milioni di morti. Nonostante uno sforzo di ricerca collaborativa senza precedenti che ha portato alla produzione di vaccini e terapie efficaci in tempi record, manca ancora una comprensione completa della struttura e del ciclo di vita del coronavirus noto come SARS-CoV-2.
Gli scienziati hanno utilizzato i laboratori biologici e lo strumento SPB/SFX dell'XFEL europeo per studiare la principale proteasi, o Mpro, del virus per capire come si protegge dal danno ossidativo. I risultati aggiungono conoscenze fondamentali alla nostra comprensione del funzionamento della SARS-CoV-2 e del campo della biologia virale.
L'articolo è pubblicato sulla rivista Nature Communications .
Tra gennaio 2020 e marzo 2023, oltre sei milioni di persone sono morte a causa della malattia respiratoria COVID-19 e diverse centinaia di milioni sono state infettate. La malattia è causata dal SARS-CoV-2, un coronavirus.
"I coronavirus sono un gruppo di virus RNA che causano malattie e malattie nei mammiferi e negli uccelli", spiega lo scienziato europeo XFEL Richard Bean. "Tuttavia, nonostante la loro significativa rilevanza per la salute umana globale, c'è ancora molto da imparare sulla struttura e sulla funzione dei coronavirus in generale e della SARS-CoV-2 in particolare."
In risposta allo scoppio della pandemia, scienziati e organizzazioni scientifiche di tutto il mondo si sono impegnati nello studio della struttura, delle dinamiche e della funzione della SARS-CoV-2 alla ricerca di vaccini e terapie. Grazie al suo ruolo centrale nel ciclo di replicazione del virus, la proteasi principale, un enzima che libera gli uni dagli altri pezzi appena formati del virus, è emersa presto come un bersaglio chiave dei farmaci antivirali.
La proteasi principale, o Mpro, è particolarmente interessante per lo sviluppo di farmaci perché svolge un ruolo centrale nella replicazione virale e anche perché è molto diversa da tutte le proteine umane. Ciò consente alle terapie di colpire specificamente il virus riducendo al minimo gli effetti collaterali che potrebbero danneggiare i pazienti. Precedenti programmi di scoperta di farmaci mirati ad altri virus hanno avuto successo utilizzando gli inibitori della proteasi virale, rendendo più probabile un esito positivo nel caso della SARS-CoV-2.
"Anche se il culmine della pandemia di COVID-19 potrebbe essere passato, c'è ancora molto valore nello studio del virus SARS-CoV-2", afferma Thomas Lane del Center for Free-Electron Laser Science (CFEL) di Amburgo. "Il COVID continua a rappresentare una significativa minaccia per la salute in tutto il mondo. Data la persistenza di questo virus e la possibile comparsa di futuri coronavirus patogeni, è imperativo sviluppare una comprensione più profonda di Mpro e del suo ruolo nella funzione virale."
In un recente esperimento presso lo strumento SPB/SFX presso l’XFEL europeo, Lane e colleghi hanno utilizzato l’intenso fascio di raggi X per studiare Mpro. Diversi studi strutturali precedenti incentrati su Mpro hanno evidenziato una serie di peculiarità.
"In primo luogo, la proteina forma una struttura 3D chiamata dimero quando si trova in alte concentrazioni", spiega lo scienziato europeo XFEL Robin Schubert, coinvolto nell'esperimento. "Questa abitudine strutturale sembra influenzare direttamente la sua attività, ma non sappiamo esattamente perché questo sia importante per il virus." Oltre ad approfondimenti chiave sulla struttura 3D, studi recenti hanno anche accennato all'importanza dei livelli di ossigeno cellulare per l'attività della proteasi.
"Sembra che anche una lieve esposizione all'ossigeno riduca l'attività di Mpro", spiega Patrick Reinke, anche lui del CFEL. Infatti, in presenza di sufficiente ossigeno, il turnover cessa del tutto. Ma questo processo è reversibile:se l'ossigeno viene rimosso, l'enzima si riattiva, suggerendo che il sistema ha sviluppato meccanismi protettivi per sopravvivere in un ambiente ossidativo.
"È stato dimostrato che lo stress ossidativo regola la funzione di altri virus, come l'HIV", aggiunge Reinke. "È stato suggerito che i cambiamenti strutturali nella proteasi le permettano di sfuggire al danno ossidativo in ambienti ricchi di ossigeno. Tuttavia, non siamo ancora sicuri di come questi meccanismi protettivi influiscano sulla forma fisica del virus."
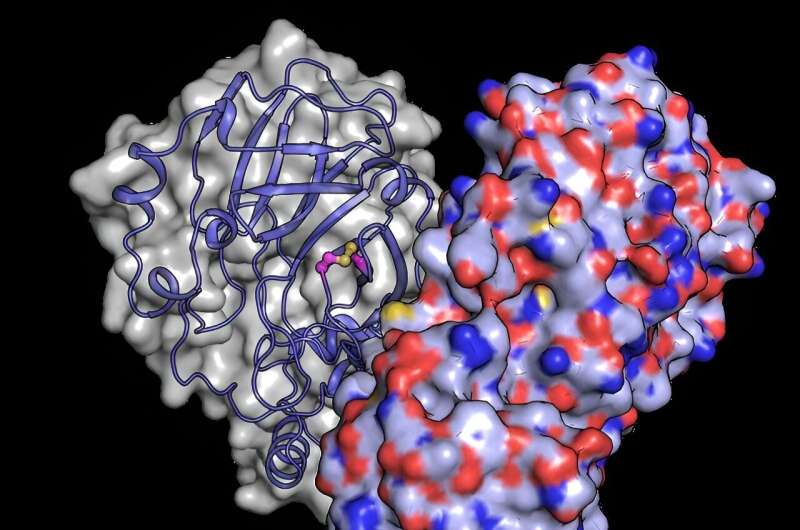
Per comprendere meglio in che modo i cambiamenti strutturali proteggono la proteina dai danni dell'ossigeno, il team ha utilizzato il potente fascio di raggi X dell'XFEL europeo per rivelare la struttura di Mpro dopo che era stato esposto all'ossigeno. Hanno scoperto un riarrangiamento strutturale di Mpro in cui si forma un legame tra due residui di cisteina:il sito attivo cisteina C145 e una cisteina distale C117.
Per raggiungere questo obiettivo, il team ha prodotto grandi quantità di Mpro nel corso di diversi mesi nei biolab dell’European XFEL e lo ha trasformato in microcristalli, alcuni dei quali sono cresciuti in presenza di ossigeno. Infine, i microcristalli sono stati fatti volare davanti al raggio XFEL europeo sullo strumento SPB/SFX utilizzando un getto liquido.
Cristalli così piccoli sono impossibili da studiare utilizzando fonti di luce tradizionali perché la quantità di radiazione necessaria per generare dati sufficienti dai cristalli li distruggerebbe. Gli impulsi di raggi X prodotti dall'XFEL europeo, tuttavia, sono così potenti e brevi che possono essere utilizzati per catturare un'immagine del cristallo proteico prima che abbia il tempo di disintegrarsi.
"I nostri risultati mostrano che il sito attivo della cisteina, che conduce la chimica dell'enzima, può nascondersi subdolamente dal danno ossidativo", afferma Schubert. In genere, l'ossidazione può danneggiare irreversibilmente le cisteine.
Dopo l'ossidazione, tuttavia, Mpro protegge la sua cisteina più importante formando quello che è noto come "legame disolfuro", che la seppellisce nel nucleo della struttura proteica. Quindi, se riportato in un ambiente sicuro e a basso contenuto di ossigeno, il legame disolfuro può rompersi, rivelando la cisteina attiva, che riprende la sua funzione originale.
"Gli esperimenti condotti presso l'XFEL europeo rivelano un'immagine della proteina nel suo stato disolfuro nascosto, confermando che esiste e scoprendo come funziona", afferma Schubert.
"Mpro presenta una serie insolitamente ricca di modifiche dell'ossidazione e il nostro esperimento aggiunge un tassello chiave a questa storia", afferma Lane. Gli scienziati sono entusiasti di ciò che indicano i loro dati e dei prossimi passi. "Mpro è un fulcro della biologia del coronavirus e il principale obiettivo per le terapie a base di piccole molecole anti-COVID-19.
"È stato dimostrato che la funzione dell'enzima è regolata sia tramite dimerizzazione che tramite ossidazione, ed è chiaro che questi meccanismi di regolazione sono biofisicamente correlati. Sebbene le nostre strutture forniscano informazioni meccanicistiche su queste proprietà di Mpro, dobbiamo ora capire come la regolazione basata sullo stress ossidativo o la concentrazione delle proteine avrà un impatto sull'idoneità virale. Ciò fornirà informazioni più approfondite sulla biologia virale e, si spera, aprirà nuove opportunità per sconvolgere tale biologia con farmaci salvavita."
Ulteriori informazioni: Patrick Y. A. Reinke et al, SARS-CoV-2 Mpro risponde all'ossidazione formando legami disolfuro e NOS/SONOS, Nature Communications (2024). DOI:10.1038/s41467-024-48109-3
Informazioni sul giornale: Comunicazioni sulla natura
Fornito da XFEL europeo