I biochimici lavorano da tempo per aggirare un punto cieco quando si tratta di proteine. Sanno che l’idrogeno costituisce quasi la metà degli atomi nelle proteine, ma il modo in cui contribuiscono alla funzione proteica in queste strutture complesse è stato meno chiaro. Gli atomi di idrogeno sono così piccoli che le tradizionali tecniche di biologia strutturale non possono rivelare la loro posizione.
"Quindi ti stai perdendo metà delle informazioni", ha affermato la dottoressa Victoria Drago, ricercatrice associata post-dottorato presso l'Oak Ridge National Laboratory (ORNL) nel Tennessee e recente alumna dell'Università di Toledo.
Non avere una contabilità completa delle posizioni degli atomi di idrogeno di una proteina è un enigma con implicazioni che vanno oltre il laboratorio, inclusa la progettazione di farmaci basati sulla struttura.
Drago ha iniziato a esplorare una tecnica per individuare idrogeni altrimenti sfuggenti che prevedeva la crescita di cristalli proteici in microgravità quando era studente laureato insieme al dottor Timothy Mueser, professore presso il Dipartimento di Chimica e Biochimica dell'UToledo.
L'analisi di questi cristalli, un termine chimico che in questo caso si riferisce alla disposizione precisa degli atomi e delle molecole che li costituiscono, è alla base di un articolo di ricerca recentemente pubblicato sulla rivista Cell Reports Physical Science .
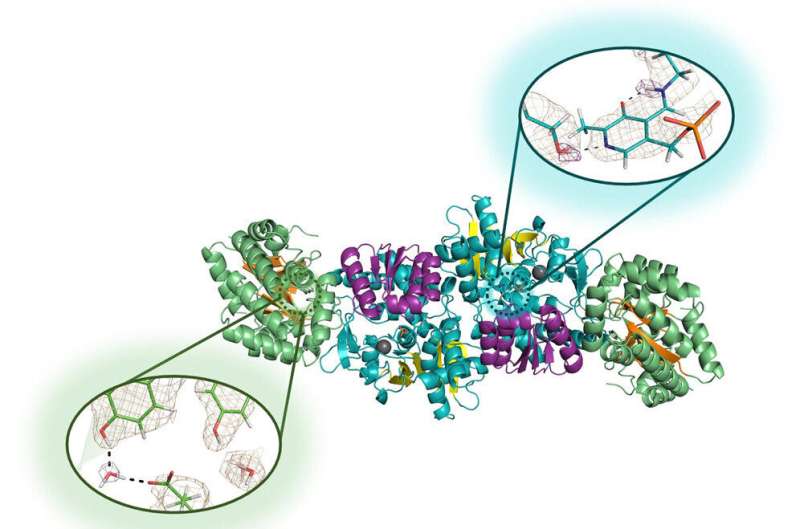
"Abbiamo utilizzato la diffrazione di neutroni", ha affermato Drago, che è l'autore principale dell'articolo e che si è laureato con un dottorato in chimica nel 2022. "Siamo stati in grado di eseguire l'esperimento e ottenere un'alta risoluzione sfruttando la microgravità per far crescere cristalli di alta qualità dell'enzima."
La diffrazione dei neutroni è un processo high-tech che consente ai ricercatori di mappare le posizioni precise di ogni singolo atomo di una molecola. Funziona per identificare le posizioni dei minuscoli atomi di idrogeno, come con altri atomi, ma il segnale è estremamente debole nelle tradizionali tecniche di biologia strutturale. Ecco perché si sono rivolti alla microgravità, che consente la crescita di cristalli più grandi e strutturati in modo più perfetto.

Drago, Mueser e i loro collaboratori dell'ORNL e dell'Institut Laue-Langevin, un importante centro di ricerca nucleare a Grenoble, in Francia, hanno inviato soluzioni dell'enzima triptofano sintasi per un tour di un mese sulla Stazione Spaziale Internazionale nel 2018, e ancora per un viaggio di sei mesi dal 2019 al 2020. Il secondo viaggio ha prodotto diversi cristalli molto grandi e perfetti - molti di circa un millimetro cubo, cinque volte più grandi di quelli che i ricercatori hanno coltivato in laboratorio - che hanno viaggiato per più di 50 milioni di miglia e sono sopravvissuti a uno schianto di 9G nell'atmosfera. Oceano Pacifico.
La diffrazione dei neutroni si è rivelata efficace su questi cristalli, consentendo ai ricercatori di rivelare per la prima volta gli idrogeni del sito attivo dell'enzima che hanno scelto di studiare.
Il triptofano sintasi è scientificamente prezioso come rappresentante di una famiglia di enzimi ampia e altamente versatile che utilizza la vitamina B6 per la sua funzione. Poiché gli esseri umani non producono triptofano sintasi, è interessante anche per i progettisti di farmaci interessati a sfruttare la struttura chimica delle proteine nello sviluppo di nuovi composti per combattere microrganismi patogeni come Salmonella enterica, Staphylococcus aureus e Mycobacterium tuberculosis.
Ulteriori informazioni: Victoria N. Drago et al, La diffrazione di neutroni da un cristallo cresciuto in microgravità rivela gli idrogeni del sito attivo della forma aldimina interna del triptofano sintasi, Cell Reports Physical Science (2024). DOI:10.1016/j.xcrp.2024.101827
Informazioni sul giornale: Cell Reports Scienze fisiche
Fornito dall'Università di Toledo