I ricercatori hanno scoperto modi per convertire i farmaci antitumorali mirati di tipo inibitori in piccole molecole note come degradatori, che aiutano a distruggere le proteine che promuovono il cancro nelle cellule.
Gli scienziati hanno selezionato molecole note per inibire alcune proteine, interrompendone la funzione, e le hanno modificate in vari modi per convertirle in degradatori di proteine, che scompongono la proteina.
Altri scienziati possono ora replicare questo nuovo approccio per sviluppare e ottimizzare una gamma di degradatori di proteine. A lungo termine, ciò potrebbe contribuire a rendere i trattamenti antitumorali esistenti più efficaci e a creare nuovi trattamenti per colpire diverse proteine coinvolte nel cancro, comprese le proteine che in precedenza potevano essere considerate "irresistibili".
La ricerca, condotta da ricercatori dell'Institute of Cancer Research di Londra, è pubblicata su ACS Chemical Biology .
Gli scienziati di tutto il mondo stanno studiando la degradazione proteica mirata come un modo per eliminare proteine specifiche note per svolgere un ruolo nello sviluppo o nella progressione del cancro. Le cellule scompongono naturalmente le proteine danneggiate o non necessarie ed è possibile dirottare questo processo introducendo le giuste molecole farmacologiche in modo che le cellule distruggano le proteine tumorali.
L'ICR è impegnato nella ricerca sulla degradazione proteica mirata come un modo per scoprire nuovi trattamenti contro il cancro. Nel 2022, un'importante donazione filantropica ha reso possibile l'apertura di un nuovo Centro per la degradazione delle proteine all'interno del Center for Cancer Drug Discovery dell'ICR.
I ricercatori hanno già ottenuto un certo successo utilizzando la proteolisi mirata alle chimere (PROTAC). Questi si legano sia alla proteina di interesse che a un enzima chiamato ubiquitina ligasi E3 per avvicinare i due. L'enzima quindi etichetta la proteina con l'ubiquitina, che la contrassegna per la distruzione da parte della cellula.
Tuttavia, il peso molecolare relativamente elevato dei PROTAC ne limita l’uso, poiché non si dissolvono bene in acqua e possono avere difficoltà a entrare nelle cellule in una concentrazione sufficientemente elevata per essere efficaci. Al contrario, se la concentrazione diventa troppo elevata, tutti i PROTAC si legano solo a uno dei due composti (l'enzima o la proteina bersaglio) anziché a entrambi, il che significa che la degradazione delle proteine è incompleta.
Una scoperta più recente è stata l'uso di degradatori monovalenti, spesso indicati come colle molecolari. Funzionano in modo simile ai PROTAC, ma modificano chimicamente la superficie dell'enzima o della proteina bersaglio in modo che i due possano legarsi direttamente. Questi composti superano i limiti dei PROTAC perché sono più piccoli e comunque efficaci a concentrazioni più elevate.
Un farmaco colla molecolare, scoperto a seguito di un programma di ricerca presso l'ICR, è già in fase iniziale di sperimentazione clinica.
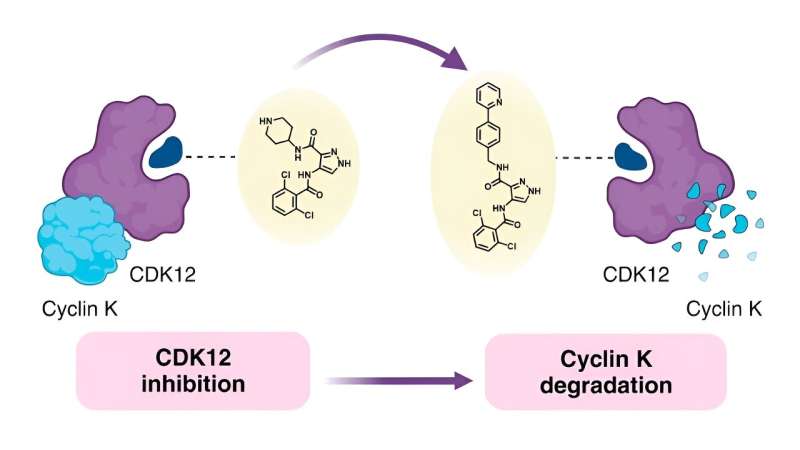
Volendo comprendere il legame tra la struttura chimica delle colle molecolari e il modo in cui si comportano, noto come relazione struttura-attività (SAR), i ricercatori dietro questo studio hanno deciso di utilizzare un noto degradatore monovalente chiamato CR8 come punto di partenza. CR8 inibisce tutte le chinasi ciclina-dipendenti (CDK), che hanno molteplici ruoli nello sviluppo del tumore, ma degrada anche la proteina ciclina K, che promuove le vie di segnalazione del cancro.
Precedenti ricerche hanno dimostrato che CR8 si lega a CDK12 e a un componente della ligasi E3 chiamato proteina legante il DNA danneggiata 1 (DDB1). Ciò consente alla cellula di scomporre la ciclina K legata al CDK12.
Forti di queste informazioni, il team ha provato a sostituire la piridina in CR8 con un'ampia gamma di sostituti. Per prima cosa hanno provato a utilizzare gruppi semplici, tra cui fluoro, metile e idrossi, prima di passare a formazioni più complesse per determinare in che modo questi cambiamenti influiscono sulla capacità di degradazione.
Nella seconda parte dello studio, i ricercatori hanno applicato le loro conoscenze approfondite sul SAR dei degradatori ad altri inibitori della CDK per determinare se i loro risultati fossero trasferibili. Hanno scoperto che i componenti molecolari che inducono la degradazione delle proteine potrebbero essere utilizzati per convertire molteplici inibitori diversi in degradatori. Hanno anche identificato alcuni sostituti che hanno portato a un miglioramento del degrado.
Prima autrice Katie Thomas, Ph.D. studente della Divisione di Terapia del Cancro presso l'ICR, ha detto:"È stato sorprendente vedere che una gamma così ampia di gruppi potrebbe essere utilizzata per indurre la degradazione della ciclina K. Ciò significa che l'interfaccia di interazione tra il degradatore legato CDK12 e DDB1 non devono essere perfettamente ottimizzati affinché si verifichi la degradazione. Ciò è promettente per il futuro dell'uso delle colle monovalenti come modalità terapeutiche:ci aiuterà a far progredire le molecole dalla scoperta fino all'ottimizzazione."
Gli inibitori della proteina chinasi sono utilizzati nel trattamento del cancro da più di due decenni. Funzionano bloccando l'azione delle proteine chinasi, enzimi che controllano la funzione delle proteine e possono portare a una crescita cellulare incontrollata se subiscono una mutazione.
Sebbene questi trattamenti possano funzionare bene, esiste il rischio che il cancro diventi resistente ad essi. Questo perché gli inibitori ostruiscono le proteine correlate al cancro invece di distruggerle e le cellule tumorali a volte possono riattivarle.
Inoltre, quando alcune proteine chinasi vengono bloccate dagli inibitori, la cellula compensa utilizzando altre chinasi per eseguire le stesse azioni.
Eliminare completamente le proteine attraverso la loro degradazione elimina questi rischi.
Questo studio funge da punto di partenza per altri ricercatori che stanno cercando di progettare colle molecolari, identificare promettenti bersagli proteici per la degradazione e sviluppare nuove molecole che possano funzionare come terapie degradanti.
Thomas ha detto:“Ipotizziamo che altri inibitori di piccole molecole potrebbero essere convertiti in degradatori attraverso l’aggiunta di determinati gruppi. Il nostro team sta attualmente esplorando se determinati gruppi possono essere uniti ad altri tipi di inibitori della chinasi per trasformarli in degradatori monovalenti. Anche il lavoro è in corso. in corso per determinare se questi composti possono degradare altre proteine."
In teoria, una volta che i ricercatori avranno acquisito una piena comprensione del SAR dei degradatori, sarà possibile rimuovere una serie di proteine che promuovono il cancro in diversi tipi di cancro. Questo approccio potrebbe quindi aprire la porta a nuovi trattamenti efficaci contro il cancro.
L'autore corrispondente, il dottor Benjamin Bellenie, scienziato senior della Divisione di terapia del cancro presso l'ICR, ha affermato:"Questo studio ha migliorato significativamente la nostra comprensione sulla progettazione dei degradatori monovalenti. Ci siamo concentrati specificamente sui degradatori della ciclina K e dobbiamo elaborare se possiamo replicare questo approccio per nuovi obiettivi. Tuttavia, riteniamo che la nostra ricerca potrebbe consentire future scoperte farmaceutiche."
Ulteriori informazioni: Katie L. Thomas et al, Degradazione in base alla progettazione:nuovi degradatori della ciclina K da vecchi inibitori di CDK, Biologia chimica ACS (2024). DOI:10.1021/acschembio.3c00616
Informazioni sul giornale: Biologia chimica ACS
Fornito dall'Istituto di ricerca sul cancro