Alcuni tipi di peptidi e microproteine per la ricerca sulla scoperta di farmaci possono essere prodotti in modo più efficiente e rapido utilizzando un solvente di reazione che aiuta a imitare il modo in cui avviene la natura.
I chimici possono ora produrre un’importante classe di piccole proteine chiamate peptidi ricchi di cisteina nella loro struttura 3D naturalmente ripiegata in modo più affidabile e molto più veloce, grazie a metodi che imitano ciò che accade all’interno delle cellule. Il progresso, ottenuto dai ricercatori della Xi'an Jiaotong-Liverpool University (XJTLU) in Cina e della Nanyang Technological University (NTU) a Singapore, è pubblicato sulla rivista Angewandte Chemie .
La cisteina è una delle tante diverse molecole di aminoacidi che possono collegarsi insieme per formare catene proteiche. I peptidi sono catene più corte di molte proteine naturali. Ciascuna molecola di cisteina contiene un atomo di zolfo che può legarsi allo zolfo di un'altra cisteina in un altro punto della proteina, tenendo insieme diverse parti della catena.
"Ricreare le forme 3D dei peptidi ricchi di cisteina è sempre stato un grosso problema nella loro produzione", afferma il dott. Shining Loo del team XJTLU. Molte proteine e peptidi bioattivi hanno molteplici legami disolfuro tra gli amminoacidi della cisteina, che sono cruciali per mantenere la loro precisa struttura ripiegata 3D. Farmaci come il linaclotide per la stitichezza e lo ziconotide per il dolore cronico sono esempi di farmaci peptidici ricchi di cisteina presenti sul mercato.
"La nostra procedura dovrebbe sbloccare nuove opportunità per la scoperta di farmaci e la produzione economicamente vantaggiosa di microproteine e peptidi ricchi di cisteina come agenti terapeutici", aggiunge il ricercatore Dr. Antony Kam del team XJTLU.
L'influenza della natura
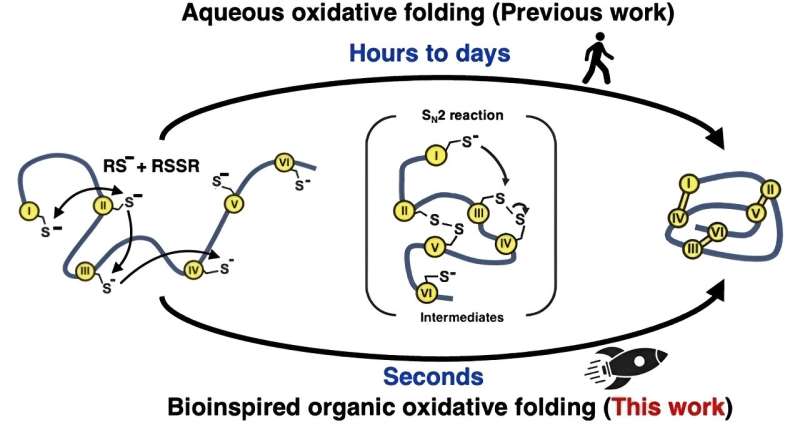
Ispirandosi al modo in cui la natura ripiega rapidamente le proteine all'interno delle cellule, i ricercatori hanno provato un approccio diverso per le reazioni di ripiegamento "ossidativo" che formano i legami disolfuro. Invece di utilizzare soluzioni a base di acqua (acquose), hanno utilizzato una miscela di solventi organici. Questo metodo imita l'enzima naturale che media la formazione dei legami disolfuro, creando un ambiente altamente reattivo per accelerare notevolmente la formazione e la riorganizzazione di questi legami.
Imparando dalla natura in questo modo, il team è stato in grado di produrre 15 diversi peptidi e microproteine, lunghi da 14 a 58 amminoacidi con da due a cinque legami disolfuro, a velocità più di 100.000 volte più veloci di quelle ottenibili con solventi acquosi. /P>
"Il ripiegamento è stato completato in modo efficiente in un secondo", osserva il dottor Loo, "e la gamma di microproteine che abbiamo prodotto dimostra che il nostro metodo dovrebbe essere efficace con una gamma molto più ampia di peptidi e microproteine nelle indagini future."
Questa scoperta è l'ultimo progresso del gruppo di ricerca XPad (XJTLU Peptide and Drug), fondato congiuntamente dal Dr. Loo e dal Dr. Kam. Questo gruppo è impegnato a utilizzare strumenti della biologia chimica, della biologia sintetica e della farmacologia molecolare per promuovere l'applicazione dei peptidi per lo sviluppo di agenti terapeutici.
"Il futuro della ricerca sui peptidi è molto promettente e ci impegniamo a fornire progressi ancora più preziosi in questo campo", conclude il dottor Kam.
Ulteriori informazioni: Antony Kam et al, Piegamento ossidativo biomimetico ultraveloce di peptidi e microproteine ricchi di cisteina in solventi organici, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317789
Informazioni sul giornale: Angewandte Chemie , Edizione Internazionale Angewandte Chemie
Fornito da Xi'an jiaotong-Liverpool University