Chi vuole produrre medicinali, plastica o fertilizzanti con metodi convenzionali ha bisogno del calore per le reazioni chimiche, ma non così nel caso della fotochimica, dove la luce fornisce l’energia. Inoltre, il processo per ottenere il prodotto desiderato spesso richiede meno passaggi intermedi.
I ricercatori dell'Università di Basilea stanno ora facendo un ulteriore passo avanti e stanno dimostrando come è possibile aumentare di 10 volte l'efficienza energetica delle reazioni fotochimiche. Applicazioni più sostenibili ed economicamente vantaggiose sono ormai sorprendentemente vicine.
Le reazioni chimiche industriali di solito si verificano in più fasi attraverso vari prodotti intermedi. La fotochimica consente scorciatoie, il che significa che sono necessari meno passaggi intermedi. La fotochimica consente anche di lavorare con sostanze meno pericolose rispetto alla chimica convenzionale, poiché la luce produce una reazione in sostanze che non reagiscono bene al calore. Tuttavia, fino ad ora non ci sono state molte applicazioni industriali per la fotochimica, in parte perché fornire energia tramite la luce è spesso inefficiente o crea sottoprodotti indesiderati.
Il gruppo di ricerca guidato dal professor Oliver Wenger dell’Università di Basilea descrive ora un principio fondamentale che ha un impatto inaspettatamente forte sull’efficienza energetica della fotochimica e può aumentare la velocità delle reazioni fotochimiche. I loro risultati sono pubblicati in Nature Chemistry .
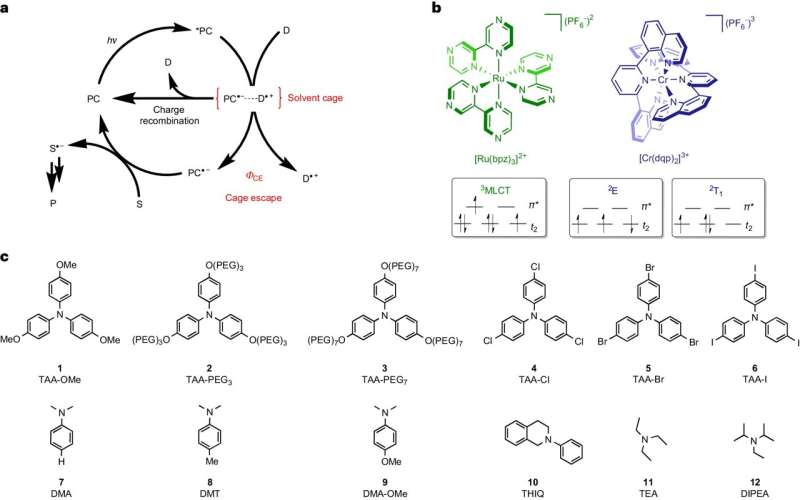
Nel caso di questo tipo di reazione, le molecole di partenza si trovano in una soluzione liquida. Se ricevono energia sotto forma di luce, possono scambiarsi elettroni e formare radicali. Queste molecole estremamente reattive si presentano sempre in coppia e rimangono circondate dal solvente, che racchiude le coppie di radicali come una sorta di gabbia.
Affinché i radicali possano continuare a reagire ai prodotti bersaglio desiderati, devono "uscire" da questa gabbia e trovare un partner di reazione al di fuori di essa. Il team che circonda Wenger e il suo dottor Cui Wang ha identificato questo processo di rottura come un passo decisivo che limita l'efficienza energetica e la velocità delle reazioni fotochimiche.
Finché i radicali rimangono in coppia nella gabbia del solvente, possono reagire spontaneamente tra loro nei materiali di partenza. Questa reazione inversa spreca energia perché utilizza solo la luce già assorbita per tornare al punto di partenza.
La squadra di Basilea è riuscita a rallentare questa reazione inversa e quindi a dare ai radicali più tempo per uscire dalla gabbia. Quanto più lunga è stata la reazione inversa indesiderata, tanto più radicali sono riusciti a scoppiare e tanto più efficienti dal punto di vista energetico e più velocemente si sono sviluppati i prodotti target desiderati.
Wang, che ora ricopre la posizione di assistente professore all'Università di Osnabrück, nel suo studio ha utilizzato due coloranti particolari, entrambi i quali assorbono la luce e immagazzinano la sua energia per un breve periodo prima di usarla per formare coppie di radicali. Tuttavia, uno dei due coloranti esaminati era in grado di immagazzinare molta più energia dell'altro e di trasferirla ai radicali.
Grazie all'energia aggiuntiva, i radicali potevano lasciare la gabbia del solvente in modo fino a dieci volte più efficiente. Di conseguenza, i prodotti target vengono realizzati con un’efficienza energetica fino a dieci volte superiore. "Questo collegamento diretto tra i radicali che fuoriescono dalla gabbia del solvente e la formazione efficiente dei prodotti target è sorprendentemente chiaro", ha affermato Wang.
La scoperta chiave è che alcuni coloranti possono rilasciare più radicali di altri in base alla quantità di luce assorbita. "La scelta del colorante può essere utilizzata per aumentare l'efficienza energetica delle reazioni fotochimiche", ha affermato Wenger. A sua volta afferma che l'efficienza energetica è un criterio decisivo anche per l'uso industriale della fotochimica.
Ulteriori informazioni: La fuga dalla gabbia governa i tassi di reazione fotoredox e le rese quantistiche, Chimica naturale (2024). DOI:10.1038/s41557-024-01482-4
Fornito dall'Università di Basilea