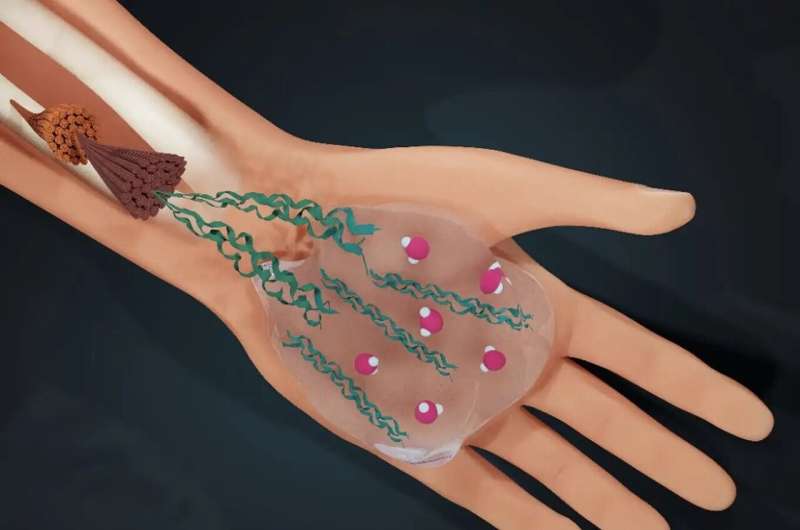
L’acqua determina la vita:l’uomo è composto per tre quarti da acqua. Un gruppo di ricerca internazionale guidato dall'Università di Amsterdam (UvA) ha ora scoperto come l'acqua determina anche la struttura del materiale che ci tiene insieme:il collagene.
In un articolo pubblicato su PNAS , i ricercatori chiariscono il ruolo dell'acqua nell'autoassemblaggio molecolare del collagene. Dimostrano che sostituendo l'acqua con la sua "molecola gemella" acqua pesante (D2 O), è possibile "sintonizzare" l'interazione tra le molecole di collagene e quindi influenzare il processo di autoassemblaggio del collagene. I risultati aiuteranno a comprendere meglio i fallimenti tissutali derivanti da malattie ereditarie legate al collagene, come la malattia delle ossa fragili (osteogenesi imperfetta).
Come afferma l'autrice principale, la Dott.ssa Giulia Giubertoni dell'Istituto Van 't Hoff per le Scienze Molecolari (HIMS) dell'UvA:"Nello studio di queste e di altre malattie del collagene, molti ricercatori, me compreso, ... hanno sempre perso una parte importante del enigma, e la possibilità che il cedimento del tessuto potesse essere in parte dovuto all'interazione acqua-collagene non è stata presa molto sul serio. Ora dimostriamo che perturbare lo strato d'acqua attorno alla proteina, anche solo leggermente, ha effetti drammatici sull'assemblaggio del collagene."
Giubertoni vuole sensibilizzare i ricercatori della comunità che si occupa delle malattie del collagene che cambiamenti molto sottili nell'interazione acqua-collagene potrebbero contribuire alle malattie del collagene. Questi cambiamenti possono potenzialmente derivare, ad esempio, da mutazioni nella proteina del collagene che si verificano nelle malattie genetiche. I ricercatori suggeriscono inoltre che le interazioni alterate tra acqua e collagene contribuiscono a varie malattie legate all'età che comportano disfunzioni dei tessuti.
Il collagene è in larga misura "la sostanza di cui siamo fatti":circa un terzo di tutte le proteine del nostro corpo è costituito da collagene, che garantisce l'integrità meccanica di tutto il tessuto connettivo umano.
Ad esempio, la nostra pelle e le nostre arterie si allungano senza lacerarsi e le nostre ossa possono resistere a stress elevati senza rompersi. Il collagene è prodotto dalle nostre cellule come singole proteine che si assemblano in strutture più grandi chiamate fibrille. Queste fibrille si assemblano ulteriormente in reti che formano le impalcature per i nostri tessuti.
Poiché il collagene si forma nell’ambiente acquoso delle cellule umane, l’acqua svolge un ruolo cruciale nel suo assemblaggio. L'interazione delle molecole d'acqua con le proteine produce il collagene più adatto alla sua funzione. Ma cosa si nasconde esattamente dietro questo ruolo dell’acqua di ottimizzazione del collagene? Come fa l'acqua? E la comprensione di questo meccanismo consentirà di comprendere meglio le condizioni in cui c’è qualcosa che non va nel collagene, come l’osteogenesi imperfetta? Queste erano le domande centrali della ricerca pubblicata su PNAS .
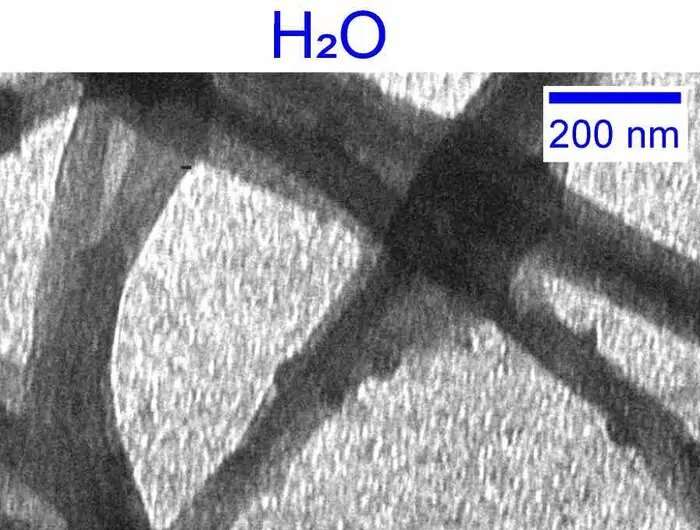
Introduzione all'acqua pesante
Per studiare il ruolo dell'acqua nella formazione del collagene, Giubertoni, insieme al suo collega UvA, il Prof. Sander Woutersen, e al loro collaboratore, il Prof. Gijsje Koenderink (Università di Tecnologia di Delft), hanno deciso di sostituire l'acqua con la sua "molecola gemella" più pesante D 2 O. Scoperto inizialmente dal premio Nobel Harold Urey nel 1931, in D2 O gli atomi di idrogeno (H) dell'acqua vengono sostituiti con l'isotopo deuterio (D) che ha un neutrone aggiunto nel suo nucleo. D2 O o "acqua pesante" è quindi il "sostituto più vicino" all'acqua ordinaria in natura.
Tuttavia, in interazione con le proteine, D2 O è meno potente di H2 O. Questo perché i legami tra D2 Le molecole di O (i cosiddetti legami idrogeno) sono più forti di quelle tra H2 molecole O. Ciò influenza l'interazione con proteine come il collagene.
Giubertoni, Woutersen e Koenderink desideravano studiare l'effetto che ciò avrebbe avuto sull'assemblaggio del collagene. Insieme a una rete di ricerca collaborativa multidisciplinare, sono stati in grado di stabilire che l'uso di acqua pesante determina una formazione di collagene dieci volte più rapida e, in definitiva, una rete di fibre di collagene meno omogenea, più morbida e meno stabile.
La spiegazione è che la ridotta interazione dell'acqua pesante con la proteina del collagene rende più facile per la proteina "scrollarsi di dosso" il D2 O molecole e si riorganizza.
Ciò aumenta la formazione della rete di collagene, ma si traduce anche in una rete di collagene più sciatta e meno ottimale. L'acqua agisce così come mediatore tra le molecole di collagene, rallentandone l'assemblaggio per garantire le proprietà funzionali dei tessuti viventi.
Questa scoperta offre nuove prospettive su come l’acqua influenza le caratteristiche del collagene, consentendo aggiustamenti precisi nelle proprietà meccaniche dei tessuti viventi. Crea inoltre nuove strade per la creazione di materiali a base di collagene in cui le proprietà macroscopiche possono essere controllate e perfezionate da sottili variazioni nella composizione del solvente, anziché apportare modifiche significative alla struttura chimica dei componenti molecolari.
Un approccio "investigativo" simile potrebbe essere utilizzato anche in futuro per chiarire il ruolo dell'acqua nel guidare e guidare l'assemblaggio di altre proteine capaci di assemblarsi in strutture più grandi. Giubertoni passerà allo studio di come i difetti del collagene influenzano la sua interazione con l'acqua, e quale ruolo questo gioca nel cedimento dei tessuti nelle malattie del collagene.
Ulteriori informazioni: Giulia Giubertoni et al, Chiarire il ruolo dell'acqua nell'autoassemblaggio del collagene modulando isotopicamente l'idratazione del collagene, Atti dell'Accademia Nazionale delle Scienze (2024). DOI:10.1073/pnas.2313162121
Informazioni sul giornale: Atti dell'Accademia Nazionale delle Scienze
Fornito dall'Università di Amsterdam