Anche se potresti non aver mai sentito parlare della superfamiglia di enzimi del citocromo P450, queste proteine svolgono ruoli diversi e critici negli esseri umani attraverso il trattamento metabolico di farmaci, pesticidi, acidi grassi, vitamine liposolubili e agenti cancerogeni chimici e la biosintesi di steroidi essenziali, compresi gli steroli.
Gli steroli sono una famiglia di composti chimici che condividono una struttura centrale ad anello e che sono fondamentali per la vita di una moltitudine di organismi. Lo sterolo più conosciuto negli esseri umani è il colesterolo, un componente chiave della nostra membrana cellulare e un elemento sempre presente nella mente dei medici considerando che livelli elevati di colesterolo nel sangue possono aumentare il rischio di malattie cardiovascolari.
Il laboratorio di Fred Guengerich, Tadashi Inagami, Ph.D. Professore di Biochimica alla Vanderbilt University, studia il citocromo P450 da 50 anni. In un nuovo articolo pubblicato su Angewandte Chemie , il laboratorio Guengerich ha studiato il meccanismo utilizzato dal citocromo P450 51, un enzima P450 presente in tutte le famiglie viventi, per catalizzare una reazione critica in tre fasi nella biosintesi degli steroli:il metabolismo del lanosterolo.
"Si è trattato di un progetto impegnativo ma gratificante che fornisce la prima risposta inequivocabile a una questione meccanicistica di lunga data e controversa nella biosintesi degli steroli eucariotici", ha affermato l'autore principale e studente laureato in biochimica Kevin McCarty.
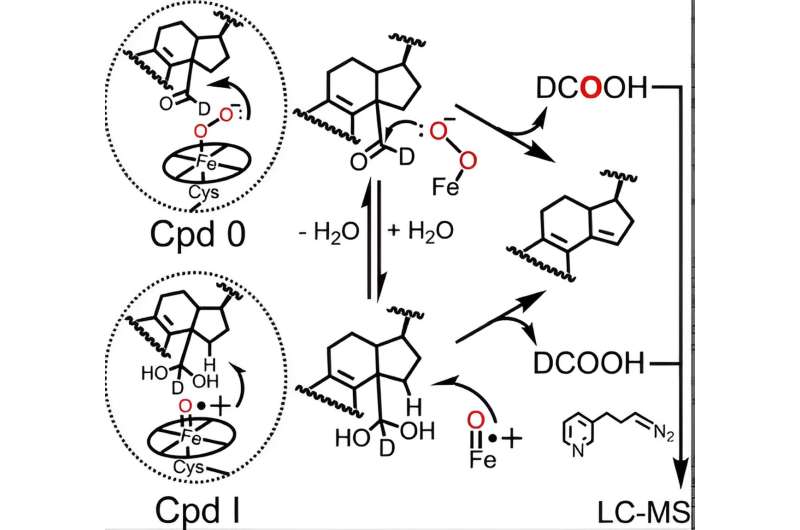
Il ciclo catalitico di tutti gli enzimi P450 prevede la formazione di due specie attive di ferro eme, il Composto 0 e il Composto I, l'ultimo dei quali è formato naturalmente dal Composto 0, necessarie per le reazioni catalizzate dal P450, compreso il metabolismo del lanosterolo. Sebbene il ruolo del Composto I nelle prime due fasi del metabolismo del lanosterolo sia stato ben stabilito, i dati contrastanti provenienti da vari laboratori hanno lasciato agli scienziati poco chiari sul fatto se P450 51 utilizzi il Composto 0 o il Composto I per realizzare il passaggio finale cruciale.
Utilizzando una tecnica analitica avanzata inizialmente perfezionata dall'ex postdoc di Guengerich Francis Yoshimoto che traccia l'incorporazione di un isotopo dell'ossigeno chiamato 18 O nei prodotti della reazione P450, McCarty e colleghi sono stati i primi a suggerire che sia il Composto 0 che il Composto I possono svolgere ruoli chimici attivi nell'ultima fase del metabolismo del lanosterolo.
Infatti, i risultati presentati nella Angewandte Chemie l'articolo indica che mentre il Composto 0 è la principale specie eme responsabile dell'ultimo passaggio dell'azione catalitica del P450 51 umano (~85% della reazione), il Composto I svolge ancora un ruolo minore e quantificabile (~14% della reazione). /P>
In collaborazione con Galina Lepesheva, professoressa di ricerca di biochimica, i ricercatori hanno confrontato i contributi relativi di ciascuna specie di eme in quattro enzimi P450 51 provenienti da lievito patogeno, ameba e tripanosomi, un tipo di parassita, all'ortologo umano. Mentre gli enzimi del lievito e dell'ameba hanno mostrato risultati simili a quelli della proteina umana, i risultati degli enzimi tripanosomici hanno rivelato un'interessante differenza meccanicistica:il Composto 0 e il Composto I hanno condiviso contributi più o meno uguali alla reazione.
Questi risultati approfondiscono la nostra comprensione collettiva e meccanicistica degli enzimi P450, in particolare quelli coinvolti nella biosintesi degli steroli.
"Si è trattato di un lungo progetto che ha richiesto una sintesi chimica in 17 fasi, cinque diversi enzimi P450 51 purificati dalla nostra collaboratrice Prof. Galina Lepesheva, un'attenzione molto attenta all'utilizzo di un'atmosfera di 18 ossigeno nelle reazioni, una sofisticata spettrometria di massa ad alta risoluzione, e un lavoro attento da parte di tutti gli autori nel nostro laboratorio," ha detto Guengerich. Secondo lui, l'attenzione ai dettagli del suo team ha permesso di "craccare questo sistema" e fornire un'analisi chiara di un meccanismo enzimatico biforcato.
"I nostri risultati forniscono un importante progresso nella comprensione della funzione del P450 51 nell'uomo e in vari agenti patogeni, che speriamo possa essere utile nella continua ricerca di farmaci mirati al P450 51", ha affermato McCarty.
Attualmente, numerosi farmaci antifungini esistenti inibiscono gli enzimi fungini P450 51 interferendo con la capacità dell'organismo di produrre steroli essenziali e riprodursi. Tuttavia, la resistenza agli antifungini, unita all'esistenza di infezioni fungine potenzialmente letali per le quali non esiste alcun trattamento, sottolinea la continua necessità di nuovi farmaci mirati al P450 51.
Guardando al futuro, i laboratori Guengerich e Lepesheva analizzeranno ulteriormente un enzima P450 51 dell'ameba alla ricerca di peculiarità meccanicistiche che potrebbero essere sfruttabili come potenziali bersagli farmacologici.
Ulteriori informazioni: Kevin D. McCarty et al, L'etichettatura dell'ossigeno-18 rivela un meccanismo misto Fe−O nell'ultimo passaggio della demetilazione dello sterolo 14α del citocromo P450 51, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317711
Fornito dalla Vanderbilt University