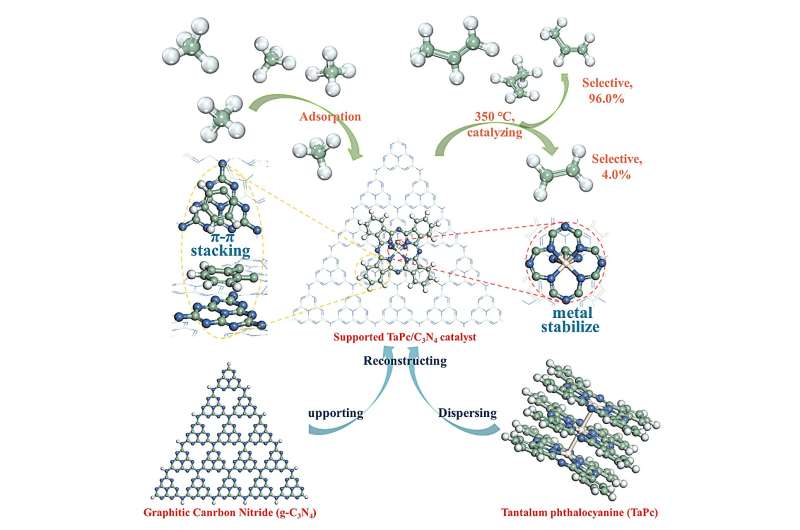
L'accoppiamento non ossidativo del metano (NOCM) presenta prospettive promettenti in quanto fornisce idrocarburi e idrogeno a valore aggiunto con un'elevata economia atomica. Tuttavia, la sfida rimane la conversione diretta e selettiva del metano in idrocarburi più preziosi come le olefine.
Il lavoro attuale presenta un catalizzatore con atomi di Ta ben dispersi ancorati da g-C3 N4 ftalocianina supportata. Un tale catalizzatore è in grado di convertire selettivamente il metano in etilene e propilene a una temperatura relativamente bassa (350 o C).
Sono state descritte la concezione del centro attivo e la costruzione del catalizzatore, e sono state discusse le origini della prestazione catalitica. I risultati rilevanti sono stati pubblicati in Ricerca sotto il titolo "Conversione diretta del metano in propilene".
La crescente disponibilità di gas naturale a basso costo e di provenienza abbondante porta ad un crescente interesse per la sua conversione in prodotti chimici a valore aggiunto. Il gas naturale è composto prevalentemente da idrocarburi piccoli, con il metano che tipicamente assume una frazione volumetrica di circa il 70-90%. Al giorno d'oggi, sono stati fatti grandi sforzi per convertire il metano in sostanze chimiche più utili attraverso percorsi diretti o indiretti.
Il percorso indiretto che coinvolge il reforming del metano e i processi Fischer-Tropsch svolge un ruolo cruciale nell’industria, poiché fornisce una delle classi più importanti di sostanze chimiche:le olefine. Tuttavia, una tale sequenza di conversione in due fasi spreca una parte considerevole delle molecole di metano producendo inevitabilmente CO2 inutile. e H2 O. Al contrario, la conversione diretta del metano accorcia i percorsi di reazione e utilizza una maggiore percentuale di metano.
Generalmente, esistono due vie principali per la conversione diretta del metano in olefine leggere, ovvero l'accoppiamento ossidativo del metano (OCM) e l'accoppiamento non ossidativo del metano (NOCM). Il processo OCM utilizza un ossidante per superare le restrizioni termodinamiche e rendere la reazione esotermica.
Tuttavia, sottoprodotti come la CO2 e H2 O sono ancora inevitabili, diminuendo l’economia atomica. Dagli anni ’90 sono stati compiuti numerosi sforzi per produrre idrocarburi attraverso processi NOCM. Tuttavia, permangono le sfide legate alle alte temperature di reazione e alla cottura.
Per indebolire il legame Ta-C è necessario un centro Ta ricco di elettroni. Ciò è supportato da un precedente rapporto sull'attivazione termica altamente efficiente del metano da parte di [TaN] + nella fase gassosa. Pertanto, un'unità Ta-N è generalmente preferibile per la conversione del metano e un'unità Ta-N4 il centro può essere costruito in fase condensata. Qui è stato preparato un catalizzatore con Ta-N4 centro come ancorato nella ftalocianina, ed è supportato da g-C3 N4 al fine di stabilizzare il centro mentale e disperdere la Ta ftalocianina (TaPc) tramite l'impilamento π-π.
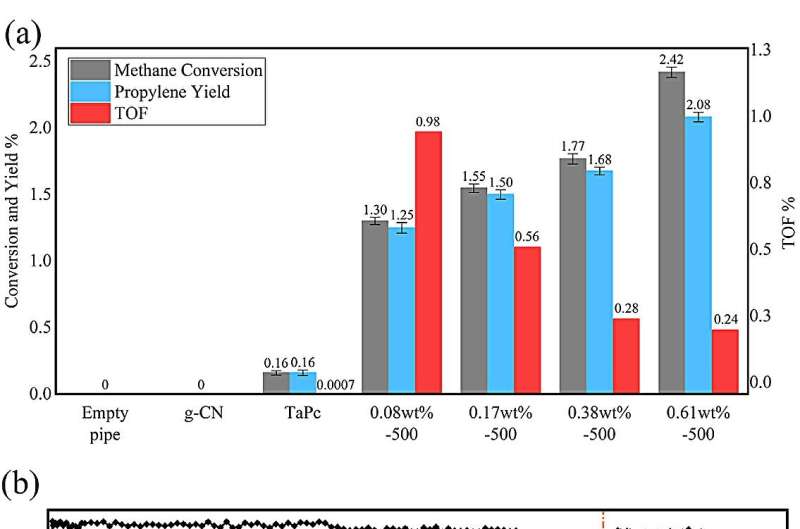
Attraverso l'attivazione sotto flusso di idrogeno, il TaPc/C3 così preparato N4 i catalizzatori mostrano un'attività sorprendentemente elevata verso la conversione del metano. Il campione con una percentuale di Ta dello 0,08% fornisce il TOF più alto con la valvola di 0,99 s -1 a 350 ℃.
In questa condizione la selettività del propilene arriva fino al 96,0%, corrispondente al 4,0% di etilene. Inoltre, nel test di durata, il campione con lo 0,08% in peso di Ta offre una lunga durata in un singolo ciclo di> 300 ore a 350 ℃ con conversione stabile del metano; dopo la riattivazione dura ancora> 120 h.
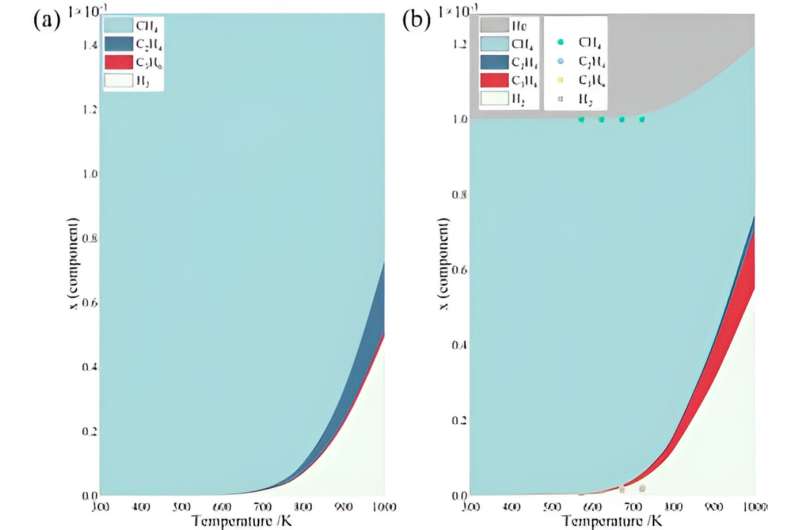
Secondo la formula di Gibbs-Helmholtz viene valutato il limite termodinamico di questo lavoro. Considerando una reazione consecutiva di accoppiamento, si mostra che la conversione osservata sperimentalmente si avvicina quasi al suo limite termodinamico a una temperatura inferiore.
Inoltre, a parità di pressione totale, il gas inerte svolge effettivamente un ruolo di diluizione nel sistema. Secondo il principio di Le Chatelier, con un coefficiente stechiometrico positivo, il processo NOCM è favorito da una conversione più elevata. Inoltre, la presenza del gas inerte consente una condensazione più profonda del sistema, facilitando così la produzione di propilene. In alternativa, è stata considerata anche la possibilità che i NOCM procedano come processi paralleli, mentre è stata riscontrata un'inconsistenza nella modellazione cinetica.
Inoltre, sono stati eseguiti calcoli di chimica quantistica per sondare le origini delle prestazioni del TaPc/C3 N4 catalizzatore. Un modello con TaPc(C32 N8 H16 Ta) supportato su C3 N4 (C90 N123 H15 ) tramite l'impilamento π-π è stato così costruito.
Il metodo di calcolo semiempirico Extended Tight-Binding (xTB) è stato impiegato insieme al codice gau_xtb per eseguire calcoli fattibili su un modello così grande. Qui ci siamo concentrati sul motivo per cui etilene e propilene corrispondono al prodotto principale.
Secondo il calcolo il ponte N-CR2 -Ta (R =H, CH3 ) fungono da intermedi chiave, che consentono la propagazione della catena del carbonio o, in alternativa, si isomerizzano per rilasciare molecole di olefina. Considerando il ruolo vitale che l'atomo Ta gioca nella trasformazione in cui funge da corriere per fornire sia carbonio che idrogeno, molto probabilmente, qui, gli effetti relativistici hanno indotto ancora una volta forti funzioni di interazione Ta-C/H.
Gli sforzi futuri potrebbero concentrarsi su come caricare in modo uniforme un contenuto più elevato di Ta ben disperso su un materiale a base di carbonio e su come migliorare la stabilità chimica del Ta-N4 struttura. Inoltre, gli effetti relativistici esercitano un'influenza simile sulle fasi gassosa e condensata, il che ci incoraggia a continuare la costruzione guidata dalla fase gassosa di catalizzatori ad alte prestazioni.
Infatti, gli studi in fase gassosa ci permettono di correlare varie caratteristiche strutturali/elettroniche con le prestazioni del centro attivo, mentre la difficoltà maggiore risiede ancora nel modo in cui queste caratteristiche favorevoli vengono replicate nei sistemi sfusi. Per quanto riguarda la conversione diretta del metano in idrocarburi superiori, molto probabilmente, è necessaria una struttura centrata su elementi 5d in modo da legare fortemente gli intermedi carbonuri per un'ulteriore propagazione della catena del carbonio.
Ulteriori informazioni: Yunpeng Hou et al, Conversione diretta del metano in propilene, Ricerca (2023). DOI:10.34133/ricerca.0218
Informazioni sul giornale: Ricerca
Fornito dalla ricerca