Gli enzimi dei microrganismi possono produrre idrogeno (H2 ) in determinate condizioni, il che li rende potenziali biocatalizzatori per l'H2 di origine biologica tecnologie. Per rendere efficiente la produzione di idrogeno, i ricercatori stanno cercando di identificare ed eliminare i possibili fattori limitanti. Questi includono la formaldeide, che si trova naturalmente come prodotto metabolico nelle cellule e inibisce l'idrogenasi [FeFe] particolarmente efficiente.
Un team del gruppo di lavoro Photobiotechnology dell'Università della Ruhr a Bochum, in Germania, è riuscito a chiarire e disattivare questo meccanismo sottostante. I ricercatori hanno riportato i loro risultati nel Journal of the American Chemical Society il 20 novembre 2023.
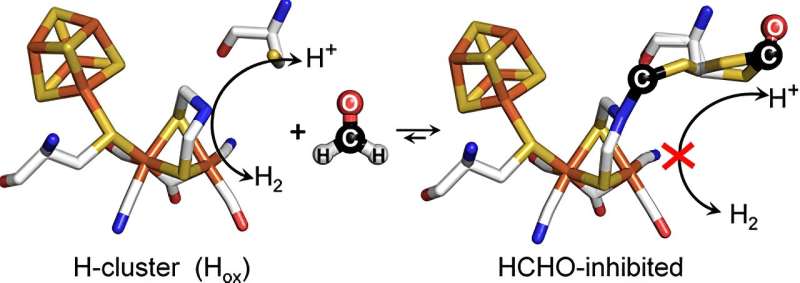
La formaldeide è nota, tra le altre cose, come conservante, ma si trova anche come metabolita naturale nelle cellule viventi. Dodici anni fa, scienziati dell’Università di Oxford, nel Regno Unito, e dell’Università della Ruhr di Bochum, in Germania, hanno dimostrato che questa molecola onnipresente inibisce una certa classe di biocatalizzatori, vale a dire le idrogenasi particolarmente efficienti del tipo a due ferro, le cosiddette idrogenasi [FeFe]-idrogenasi.
"Questa è stata una scoperta interessante, perché la formaldeide potrebbe inibire sia il naturale H2 metabolismo dei microrganismi e delle idrogenasi isolate nelle applicazioni biotecnologiche," spiega il dottor Jifu Duan, primo autore dello studio.
Dopo che vari studi teorici avevano ipotizzato come la molecola di formaldeide potesse influenzare la [FeFe]-idrogenasi, un team di ricercatori guidato da Duan e dal professor Eckhard Hofmann dell'Università della Ruhr è ora riuscito a chiarire sperimentalmente il meccanismo molecolare. Utilizzando strutture di [FeFe]-idrogenasi trattate con formaldeide ottenute mediante cristallografia proteica, sono stati in grado di dimostrare che la formaldeide reagisce con il cosiddetto centro attivo dei biocatalizzatori, una parte proteica inorganica in cui protoni ed elettroni vengono convertiti in H 2 .

Inoltre, però, la formaldeide si combina con un'altra parte proteica molto importante, necessaria per il trasporto dei protoni attraverso un gruppo chimico contenente zolfo al centro attivo. Quando gli scienziati hanno sostituito questa parte con un'altra, la formaldeide difficilmente è riuscita a esercitare il suo effetto inibitorio.
"Le future applicazioni biotecnologiche delle [FeFe]-idrogenasi potrebbero comportare la presenza di formaldeide, in modo che i nostri biocatalizzatori modificati resistenti alla formaldeide possano essere utilizzati qui", spiega Duan. "Crediamo inoltre che le nostre scoperte possano essere trasferite ad altri biocatalizzatori." Ciò potrebbe svolgere un ruolo importante per i processi industriali a base biologica, ma anche per comprendere i percorsi metabolici negli organismi viventi.
Ulteriori informazioni: Jifu Duan et al, Approfondimenti sul meccanismo molecolare dell'inibizione della formaldeide delle [FeFe]-idrogenasi, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c07800
Informazioni sul giornale: Giornale dell'American Chemical Society
Fornito da Ruhr-Universitaet-Bochum