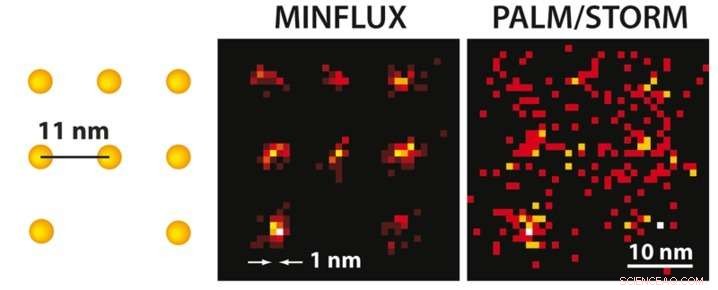
Con la microscopia MINFLUX si può, per la prima volta, separare otticamente le molecole che distano solo pochi nanometri l'una dall'altra. Sulla sinistra, viene presentato uno schema delle molecole fluorescenti. Considerando che la microscopia PALM/STORM ad altissima risoluzione alla stessa luminosità molecolare (a destra) fornisce un'immagine diffusa delle molecole (qui in una simulazione in condizioni tecniche ideali), la posizione delle singole molecole può essere facilmente individuata con il pratico MINFLUX (al centro). Credito:MPI f. Chimica biofisica/ K. Gwosch
È il Santo Graal della microscopia ottica:migliorare il potere risolutivo di questo metodo in modo tale da poter distinguere individualmente molecole molto vicine tra loro. Gli scienziati del premio Nobel Stefan Hell dell'Istituto Max Planck per la chimica biofisica di Göttingen hanno ora raggiunto ciò che per lungo tempo è stato considerato impossibile:hanno sviluppato un nuovo microscopio a fluorescenza, chiamato MINFLUX, permettendo, per la prima volta, separare otticamente le molecole, che distano solo nanometri (un milionesimo di millimetro) l'uno dall'altro. Questo microscopio è più di 100 volte più nitido della microscopia ottica convenzionale e supera anche i migliori metodi di microscopia ottica a super-risoluzione fino ad oggi, vale a dire STED sviluppato da Hell e PALM/STORM descritto dal premio Nobel Eric Betzig, fino a 20 volte. Per MINFLUX, Hell ha utilizzato i vantaggi di STED e PALM/STORM in un concetto completamente nuovo. Questa svolta apre nuove opportunità ai ricercatori per studiare come funziona la vita a livello molecolare.
"Abbiamo raggiunto regolarmente risoluzioni di un nanometro con MINFLUX, che è il diametro delle singole molecole - il limite ultimo di ciò che è possibile nella microscopia a fluorescenza, " spiega l'inferno, Direttore dell'Istituto Max Planck di chimica biofisica. "Sono convinto che i microscopi MINFLUX abbiano il potenziale per diventare uno degli strumenti più fondamentali della biologia cellulare. Con questo concetto sarà possibile mappare le cellule in dettaglio molecolare e osservare i processi rapidi al loro interno in tempo reale. Ciò potrebbe rivoluzionare la nostra conoscenza dei processi molecolari che si verificano nelle cellule viventi".
Il fisico di Gottinga, che lavora anche al Max Planck Institute for Medical Research e al German Cancer Research Center di Heidelberg, è da tempo convinta che la risoluzione della microscopia a fluorescenza possa essere aumentata fino alla dimensione delle singole molecole, con l'uso classico della luce focalizzata e delle lenti convenzionali.
Infatti, il fisico Ernst Abbe aveva formulato nel 1873 che la risoluzione dei microscopi ottici è limitata alla metà della lunghezza d'onda della luce, che è di circa 200 nanometri. Più di 100 anni dopo, questo limite di Abbe è ancora valido. Però, Hell è stato il primo a dimostrare che questo limite può essere superato con la microscopia STED, che ha ideato nel 1994 e stabilito sperimentalmente cinque anni dopo.
STED così come PALM/STORM, sviluppato qualche anno dopo, in pratica raggiungono una nitidezza di separazione di circa 20-30 nanometri, circa dieci volte migliore del limite di Abbe. Per lo sviluppo di queste tecniche di microscopia ottica ad altissima risoluzione, Hell e Betzig insieme a William E. Moerner hanno ricevuto il Premio Nobel 2014 per la Chimica.
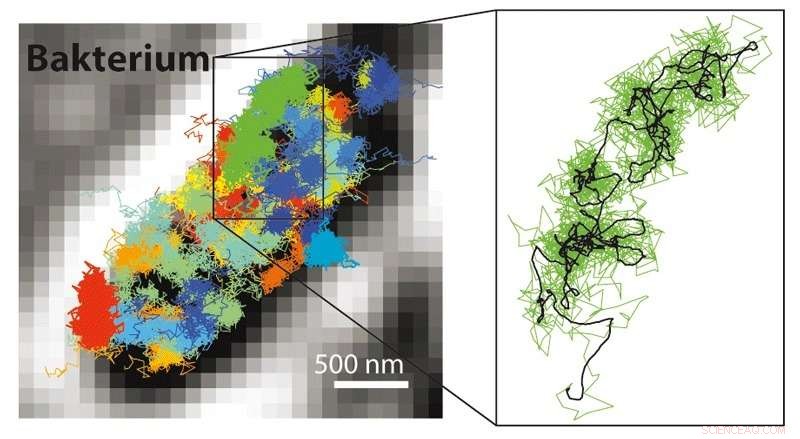
Con MINFLUX è possibile seguire molti movimenti molto più veloci di quelli possibili con la microscopia STED o PALM/STORM. È quindi possibile rendere visibili i movimenti delle molecole marcate con fluorescenza in una cellula vivente. A sinistra:schema di movimento dei ribosomi 30S (parti di fabbriche di proteine, colorato) in un batterio E. coli (bianco-nero). A destra:schema di movimento di un singolo ribosoma 30S (verde) mostrato ingrandito. Credito:MPI f. Chimica biofisica/ Y. Eilers
Vantaggi di STED e PALM/STORM combinati
Sia STED che PALM/STORM separano le molecole fluorescenti vicine accendendole e spegnendole una dopo l'altra in modo che emettano fluorescenza in sequenza. Però, i metodi differiscono in un punto essenziale:la microscopia STED utilizza un raggio laser a forma di ciambella per disattivare la fluorescenza molecolare in una posizione fissa nel campione, cioè ovunque nella regione focale tranne al centro della ciambella. Il vantaggio è che il raggio della ciambella definisce esattamente in quale punto dello spazio si trova la corrispondente molecola incandescente. Lo svantaggio è che in pratica il raggio laser non è abbastanza forte da confinare l'emissione ad una singola molecola al centro della ciambella. Nel caso di PALM/STORM, d'altra parte, l'accensione e lo spegnimento avvengono in posizioni casuali ea livello di singola molecola. Il vantaggio qui è che si sta già lavorando a livello di singola molecola, ma uno svantaggio è che non si conoscono le posizioni esatte delle molecole nello spazio. Le posizioni devono essere trovate raccogliendo quanti più fotoni di fluorescenza possibile su una macchina fotografica; più di 50, Sono necessari 000 fotoni rilevati per raggiungere una risoluzione inferiore a 10 nanometri. In pratica, quindi non è possibile ottenere di routine una risoluzione molecolare (un nanometro).
Hell ha avuto l'idea di combinare in modo univoco i punti di forza di entrambi i metodi in un nuovo concetto. "Questo compito era tutt'altro che banale. Ma i miei collaboratori Francisco Balzarotti, Yvan Eilers, e Klaus Gwosch hanno fatto un ottimo lavoro nell'implementare sperimentalmente questa idea con me." La loro nuova tecnica, denominati MINFLUX (FLUSSI MINIMI di emissione), è ora introdotto da Hell insieme ai tre giovani scienziati come primi autori in Science.
MINFLUSSO, come PALMA/TEMPESTA, accende e spegne le singole molecole in modo casuale. Però, allo stesso tempo, le loro posizioni esatte sono determinate con un raggio laser a forma di ciambella come in STED. A differenza di STED, il raggio della ciambella qui eccita la fluorescenza. Se la molecola è sull'anello, brillerà; se è esattamente al centro oscuro, non brillerà ma si è trovata la sua esatta posizione. Balzarotti ha sviluppato un algoritmo intelligente in modo che questa posizione potesse essere localizzata molto velocemente e con alta precisione. "Con questo algoritmo è stato possibile sfruttare le potenzialità del fascio di eccitazione della ciambella, " spiega il giovane scienziato. Gwosch, che ha ottenuto le immagini risolte molecolari, aggiunge "E 'stata una sensazione incredibile come noi, per la prima volta, sono stati in grado di distinguere i dettagli con MINFLUX sulla scala di pochi nanometri."
Risoluzione 100 volte migliore
Oltre alla risoluzione molecolare, la combinazione di STED e PALM/STORM offre un ulteriore grande vantaggio:"MINFLUX è molto più veloce in confronto. Poiché funziona con un raggio laser a ciambella, richiede un segnale luminoso molto più basso, cioè meno fotoni di fluorescenza, per molecola rispetto a PALM/STORM per ottenere la risoluzione finale, " Stati dell'inferno. Già con STED si potevano registrare video in tempo reale dall'interno delle cellule viventi. Ma ora era possibile tracciare il movimento delle molecole in una cellula con una risoluzione temporale 100 volte migliore, come sottolinea Eilers. È riuscito a filmare per la prima volta il movimento delle molecole in un batterio E. coli vivente con MINFLUX, con una risoluzione spazio-temporale senza precedenti. "Per quanto riguarda la velocità, non abbiamo sfruttato al massimo le possibilità con MINFLUX, " Dice Eilers. I ricercatori sono convinti che anche i cambiamenti estremamente rapidi nelle cellule viventi possano essere studiati in futuro, come ad esempio il movimento di nanomacchine cellulari o il ripiegamento di proteine.