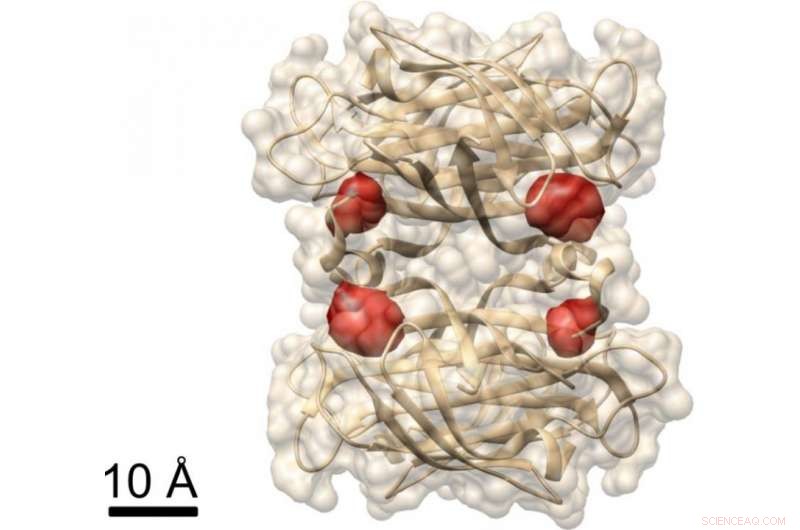
Vista di una proteina:i ricercatori di Max Planck hanno utilizzato il metodo COLD per visualizzare i quattro siti di legame della biotina (marcati da molecole di colorante rosso) nella proteina streptavidina, la cui struttura è già nota. Credito:MPI per la scienza della luce
La microscopia ottica continua a rivelare il mondo microscopico con una risoluzione sempre maggiore. Utilizzando un nuovo metodo coniato COLD, gli scienziati del Max Planck Institute for the Science of Light di Erlangen hanno ora visualizzato strutture proteiche con una risoluzione di circa 5 . COLD raggiunge questa risoluzione senza precedenti operando a una temperatura di meno 270 gradi Celsius. A temperature così basse, i segnali delle proteine fluorescenti possono essere localizzati in modo più preciso. Il metodo apre così la possibilità a basse temperature, i segnali delle proteine fluorescenti possono essere localizzati in modo più preciso. Il metodo apre così la possibilità di osservare i cambiamenti strutturali delle proteine associate a malattie specifiche.
Fino alla fine del XX secolo, i microscopi ottici erano soggetti a una restrizione importante:la loro risoluzione era limitata dalla natura ondulatoria della luce. Già nel 1873, il fisico Ernst Abbe formulò una legge che, in termini semplificati, afferma che un microscopio ottico non può risolvere strutture che misurano meno della metà della lunghezza d'onda della luce visibile, circa 200 nanometri. "Questo corrisponde a una catena di diverse migliaia di atomi, " spiega Vahid Sandoghdar, Direttore del Max Planck Institute for the Science of Light.
Questo limite era considerato insormontabile - fino a quando i ricercatori non svilupparono metodi di microscopia a fluorescenza a super risoluzione, come STED e PALM/STORM, negli ultimi due decenni. Queste tecniche hanno migliorato la risoluzione ottica a circa 20-30 nanometri. Nel 2014, gli scienziati coinvolti in quelle invenzioni, tra cui Stefan Hell al Max Planck Institute for Biophysical Chemistry a Göttingen, ricevettero il Premio Nobel per la Chimica. Recentemente, un team guidato da Hell ha aumentato il limite di risoluzione di altre venti volte con l'aiuto di una tecnica di microscopia di nuova concezione nota come MINFLUX. La risoluzione di questo metodo è stata sufficiente per distinguere le molecole vicine che distano solo pochi nanometri.
COLD permette di dare uno sguardo alle singole molecole proteiche
Vahid Sandoghdar e i suoi colleghi stanno lavorando da diversi anni su metodi alternativi per aumentare le prestazioni della microscopia a fluorescenza ad alta risoluzione - con notevole successo, come riporta il fisico di Erlangen:"Il nostro nuovo approccio ci consente di visualizzare strutture separate da una distanza inferiore a cinque angstrom, cioè mezzo nanometro. Siamo quindi in grado di esaminare le molecole proteiche." Sandoghdar e i suoi colleghi hanno presentato per la prima volta il concetto di base nel 2013, che hanno coniato COLD per la localizzazione ottica criogenica in tre dimensioni. Il nome COLD dice tutto:"La cosa fondamentale di COLD è la bassa temperatura alla quale avvengono le misurazioni, circa meno 270 gradi Celsius, "dice il fisico.
Il principio di base dell'imaging a fluorescenza è lo stesso per tutti i microscopi:il campione viene prima etichettato chimicamente con molecole fluorescenti chiamate fluorofori. Ciò rende determinate aree o componenti del campione, per esempio. cellule, visibile. Però, le tecniche convenzionali sono limitate dal limite di Abbe. Ogni volta che diversi fluorofori ravvicinati emettono luce contemporaneamente, i loro segnali si sovrappongono e non possono più essere riconosciuti come punti separati. I metodi della super risoluzione, al contrario, sono in grado di attivare e disattivare le molecole coloranti fluorescenti. Ciò consente di determinare la posizione di ciascuno con un grado di precisione relativamente elevato. Però, la precisione risente del rumore statistico:più brevemente i fluorofori emettono luce, maggiore è l'imprecisione. E di solito si accendono solo per brevissimo tempo, perché i processi chimici indotti dalla luce sbiancano la molecola.
Le molecole possono essere localizzate più precisamente a basse temperature
È qui che entra in gioco il FREDDO. Le temperature estremamente basse rallentano enormemente il fotosbiancamento in modo che ogni fluoroforo si accenda per un tempo significativamente più lungo. "Ciò riduce il rumore sulle immagini e migliora la precisione della localizzazione, " afferma Siegfried Weisenburger, che ha eseguito gli esperimenti come parte della sua ricerca di dottorato nel dipartimento di Sandoghdar.
In collaborazione con Christian Griesinger e il suo dipartimento presso il Max Planck Institute for Biophysical Chemistry a Göttingen, gli scienziati di Erlangen sono stati in grado di utilizzare la loro tecnica per risolvere due fluorofori su una proteina distanti solo un nanometro. A questa scala, anche le più piccole vibrazioni e movimenti del campione rovineranno l'esperimento. "Per misurare le distanze su scala atomica, abbiamo dovuto sviluppare uno speciale, microscopio criogenico estremamente stabile, " Spiega Sandoghdar. "I campioni vengono preparati distribuendo le proteine in una sottile pellicola polimerica su un vetrino".
Come sono disposte le proteine in una membrana?
In un altro esperimento, i ricercatori hanno dimostrato che COLD può essere utilizzato per determinare la struttura spaziale delle proteine:hanno etichettato una proteina chiamata streptavidina in quattro siti specifici con fluorofori e hanno registrato diverse centinaia di immagini. Hanno quindi ricostruito la struttura della proteina con l'aiuto di algoritmi di tomografia. In definitiva, hanno raggiunto una risoluzione tridimensionale di circa mezzo nanometro nel localizzare le quattro molecole di colorante. "Questa risoluzione consente studi di struttura al limite di altri metodi in biologia strutturale". Ciò vale soprattutto per il campo di ricerca di Christian Griesinger, spettroscopia NMR, che può risolvere solo distanze inferiori a cinque angstrom. "COLD colma il divario tra la microscopia a fluorescenza e la biologia strutturale, " dice il direttore di Max Planck a Gottinga.
I risultati sono molto rilevanti per un certo numero di scienziati. "Nelle cellule, le proteine cambiano la loro struttura per svolgere o alterare le loro funzioni. Inoltre, specifici cambiamenti strutturali sono spesso associati a malattie specifiche, " dice Sandogdar. Inoltre, COLD può determinare l'orientamento delle proteine. "L'orientamento è particolarmente interessante quando si osservano le proteine in una membrana. Questo è l'oggetto dei nostri esperimenti attuali, " spiega Daniel Böning, un membro del gruppo di ricerca a Erlangen.
Sandoghdar prevede che la risoluzione di COLD possa essere ulteriormente migliorata di un fattore dieci. La tecnica opererebbe quindi a livello atomico. Però, in tal caso andrebbe a scontrarsi con il limite intrinseco della microscopia a fluorescenza derivante dalla dimensione delle molecole marcanti utilizzate. "COLD è ideale per visualizzare proteine o aggregati più piccoli di biomolecole. D'altra parte, a causa delle temperature inospitali, la tecnica non può essere utilizzata per indagare sui processi all'interno delle cellule viventi, " Sandoghdar riassume. "Al momento, nessun metodo di microscopia è in grado di osservare tutto. Le diverse strategie devono quindi continuare ad essere utilizzate – come prima e per il prossimo futuro – in maniera complementare”.