
Radiografia dell'ugello di lavoro, che mostra il flusso proteico interno circondato dal getto di etanolo. Credito:Dominik Oberthuer, DESY
Gli scienziati sono interessati alla struttura spaziale delle proteine per conoscere il funzionamento di queste biomolecole. Questa conoscenza può portare a una migliore comprensione delle funzioni delle biomolecole e ai farmaci su misura. La cristallografia a raggi X è lo strumento principale per risolvere le strutture proteiche. Però, richiede la crescita di cristalli delle proteine in esame. Quando i raggi X colpiscono questi cristalli, sono diffratti dagli atomi per formare uno schema caratteristico da cui è possibile calcolare la struttura spaziale del cristallo, e quindi le molecole proteiche.
Però, a molte proteine non piace essere schiacciate nei cristalli in quanto contraddice il loro stato naturale. "La crescita dei cristalli proteici è complessa. La quantità di proteine che può essere prodotta è spesso limitata a pochi milionesimi di grammo, e spesso, si possono ottenere solo piccolissimi cristalli, " dice Dominik Oberthür di DESY, principale autore della relazione. Con i lampi estremamente luminosi dei laser a elettroni liberi a raggi X, anche quei microcristalli possono essere analizzati, ma di solito sono necessarie migliaia di modelli di diffrazione per risolvere la struttura proteica. Poiché i delicati microcristalli sono completamente vaporizzati dall'intenso lampo di raggi X dopo aver erogato il loro schema di diffrazione, un flusso di microcristalli freschi viene inviato attraverso il raggio laser. Questo concetto è noto come cristallografia seriale a raggi X, e ha consentito l'analisi di molte proteine precedentemente inaccessibili.
Ancora, anche quei microcristalli sono difficili da ottenere, e solo una frazione viene effettivamente colpita dal flash a raggi X, a seconda della geometria del flusso cristallino e dei parametri tecnici del laser a raggi X. "Meno cristalli, il materiale meno proteico di cui hai bisogno, più è fattibile l'analisi, " afferma Oberthür. Il team di Bajt ha concepito un nuovo concetto per un cosiddetto ugello di focalizzazione del flusso doppio (DFFN) che riduce notevolmente il consumo di cristalli proteici. Di solito, i cristalli proteici vengono iniettati con un tampone liquido vettore nel raggio di raggi X utilizzando un ugello speciale. Per formare un getto sottile, il liquido vettore viene accelerato da un veloce flusso di gas che circonda il liquido. Ma per formare un getto stabile, è necessaria una portata minima, di solito sprecando la maggior parte dei cristalli nel getto.

Concetto del nuovo ugello:un rapido getto di gas (bianco) accelera un flusso di etanolo (blu) in cui viene iniettato il tampone proteico contenente i cristalli (verde). Credito:Anton Barty, DESY, e Juraj Knoška, Università di Amburgo
Per superare queste difficoltà, il team ha aggiunto etanolo come liquido "guaina" secondario tra il gas e il tampone. Ciò fa sì che il liquido della guaina venga accelerato dal gas. I cristalli nel loro tampone possono quindi essere iniettati come un flusso molto sottile al centro del getto di etanolo. "Prima, il tampone con i cristalli doveva svolgere due compiti:formare un getto stabile e trasportare cristalli proteici, " ha spiegato Juraj Knoška, un dottorato di ricerca studente al CFEL e all'Università di Amburgo, che ha sviluppato gli ugelli. "Il nostro approccio separa questi ruoli e utilizza i liquidi che sono i migliori per il lavoro". L'etanolo ha caratteristiche ideali per formare un getto molto stabile, che scorre con solo un sottile flusso del tampone che trasporta il cristallo al centro. Per di qua, la portata del tampone potrebbe essere ridotta da circa 40 microlitri (milionesimi di litro) a soli due microlitri al minuto. Anche, la multa, flusso stabile di nanocristalli può essere mantenuto esattamente sovrapposto al piccolo raggio del laser a raggi X. Inoltre, la riduzione della portata complessiva migliora la qualità dei modelli di diffrazione e la velocità con cui i cristalli vengono effettivamente colpiti dai lampi di raggi X.
"Non solo riduciamo il consumo di cristalli, ma il nostro doppio ugello di focalizzazione del flusso rende anche più efficiente l'uso della sorgente di raggi X aumentando la velocità con cui raccogliamo modelli di diffrazione di alta qualità, " dice Bajt. "Inoltre, l'uso del liquido della guaina ci consente di studiare le proteine nei tamponi che non potevano essere iniettate prima. Il nostro concetto amplia lo spettro delle biomolecole che possono essere analizzate." Il suo team ha testato il nuovo ugello al laser a raggi X LCLS dello SLAC National Accelerator Laboratory negli Stati Uniti. Gli scienziati hanno collaborato con diversi gruppi per risolvere le strutture di varie proteine .
"Insieme al gruppo del premio Nobel Roger Kornberg della Stanford University, potremmo risolvere per la prima volta la struttura dell'enzima RNA polimerasi II a temperatura ambiente, " spiega Oberthür. "Poiché la cristallografia a temperatura ambiente è un prerequisito per studiare in dettaglio la dinamica strutturale, questo apre le porte a futuri studi risolti nel tempo o "filmati molecolari" con questo importante sistema." Il nuovo dispositivo è stato utilizzato anche per analizzare altri due enzimi, un'idrogenasi legata alla membrana e una diossigenasi, nonché nanocristalli proteici naturali, dal bozzolo protettivo di un virus specializzato (Cydia pomonella granulovirus, cpgv).
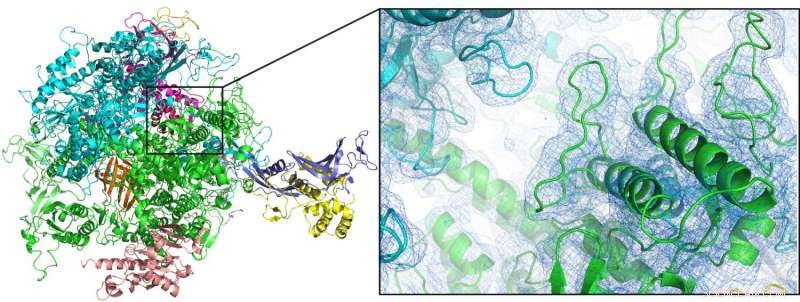
La prima struttura a temperatura ambiente dell'enzima RNA polimerasi II (qui mostrata come grafico a fumetti) potrebbe essere risolta mediante cristallografia seriale a femtosecondi utilizzando un doppio ugello a flusso focalizzato. Credito:Dave Bushnell, Università di Stanford, e Dominik Oberthür, DESY
Il doppio ugello di focalizzazione del flusso elimina anche un altro problema pratico di questa forma di iniezione a getto:di solito, a bordo degli ugelli convenzionali, materiale tampone, le proteine e i cristalli di ghiaccio d'acqua si aggregano nel tempo per formare caratteristiche simili a gocce di pietra. Lo stesso accade frequentemente nella parte inferiore del serbatoio di raccolta sotto l'ugello. Se queste stalattiti e stalagmiti di ghiaccio proteico crescono nel raggio di raggi X, non solo rendono inutile il modello di diffrazione, i loro riflessi possono essere così forti da distruggere il rilevatore. Così, di tanto in tanto, gli esperimenti devono essere sospesi per rimuovere le gocce di ghiaccio proteico. "Il liquido della guaina nel nostro ugello impedisce la formazione di tali strutture indesiderate. Il doppio ugello di focalizzazione del flusso ha consentito condizioni sperimentali stabili per molte ore, " spiega Oberthür.
"In tutti gli esperimenti l'ugello ha funzionato molto bene, " riassume Bajt. "Potremmo ridurre il numero di interruzioni da dieci a zero in un turno, e ci aspettiamo che anche le stazioni sperimentali su altri laser a raggi X e su sorgenti di luce di sincrotrone come PETRA III di DESY possano beneficiare dei vantaggi del nostro dispositivo".