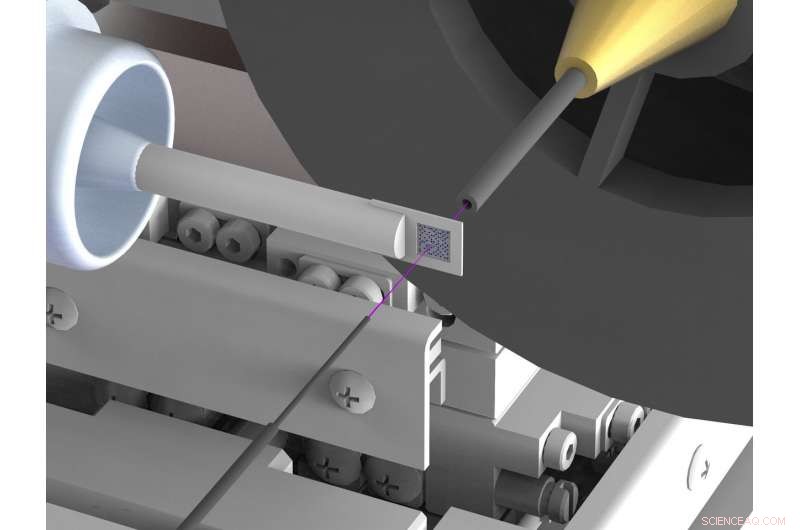
Un set-up di nuova concezione riduce enormemente la dispersione del fondo nell'analisi della struttura a raggi X di biomolecole come le proteine alle sorgenti di raggi X di sincrotrone. La dispersione spesso ostacola le determinazioni della struttura ad alta risoluzione. Per realizzare questo, il fascio di raggi X (evidenziato in rosa) è racchiuso in sottili capillari metallici poco prima e dietro il campione e l'aria immediatamente circostante il campione è sostituita da un flusso di gas elio. Credito:DESY, Julian Bergtholdt
Un set-up sperimentale di nuova concezione consente la determinazione della struttura a raggi X di biomolecole come proteine con campioni molto più piccoli e tempi di esposizione più brevi rispetto a prima. Alle cosiddette sorgenti di sincrotrone, il cristallo proteico può essere studiato in modo considerevolmente più efficiente e rapido utilizzando raggi X ad ampio spettro. Però, a causa della grande quantità di radiazione diffusa, questo ha richiesto fino ad ora cristalli molto grandi. Il nuovo apparato sperimentale ora consente di ridurre sostanzialmente la radiazione diffusa indesiderata, in modo che gli scienziati siano stati in grado di eseguire per la prima volta la cristallografia seriale utilizzando la radiazione di sincrotrone ad ampio spettro. Il team internazionale guidato dallo scienziato DESY Alke Meents ha pubblicato sulla rivista i risultati degli esperimenti presso l'Advanced Photon Source (APS) negli Stati Uniti. Comunicazioni sulla natura .
Le sorgenti di sincrotrone sono acceleratori di particelle circolari che producono raggi X luminosi. Queste sorgenti di raggi X sono i cavalli di battaglia per la determinazione della struttura delle proteine. Per chiarire la struttura spaziale di una particolare proteina, i cristalli sono cresciuti da esso e studiati con raggi X in un sincrotrone. Il cristallo diffrange i raggi X in modo caratteristico, e dal modello di diffrazione risultante la struttura interna del cristallo, e con esso la struttura della proteina può essere calcolata fino al livello atomico.
A differenza della cristallografia a raggi X convenzionale, che di solito viene eseguita su un singolo o un piccolo numero di grandi cristalli proteici, la cristallografia seriale esamina da cento a centinaia di migliaia di cristalli molto piccoli. Le informazioni raccolte vengono quindi unite per formare un set di dati da cui è possibile dedurre la struttura cristallina. Questo metodo è già stato applicato frequentemente utilizzando laser a elettroni liberi a raggi X (XFEL). Inoltre, impiegando gli impulsi a raggi X molto brevi degli XFEL, le reazioni chimiche ed enzimatiche possono essere studiate in brevi intervalli di tempo.

Immagine di diffrazione di un cristallo proteico in policromia, raggi X "rosa". Rispetto alle immagini di diffrazione a raggi X monocromatiche, l'immagine policromatica contiene molte più informazioni e sono necessari meno cristalli per determinare la struttura della proteina. Credito:DESY, Max Wiedorn
"Anche la cristallografia seriale può essere eseguita facilmente utilizzando sorgenti di sincrotrone. Tuttavia, le misurazioni richiedono più tempo con quelle fonti, perché utilizzano raggi X monocromatici di un colore specifico, con conseguente basso flusso di raggi X, " spiega Henry Chapman, scienziato leader presso DESY e coautore dell'articolo. Ai sincrotroni, di solito per questo tipo di analisi viene utilizzata solo una banda stretta di lunghezze d'onda dei raggi X, in modo che solo una piccola frazione dei fotoni a raggi X disponibili viene utilizzata per l'esperimento. "Inoltre, abbiamo bisogno di molti cristalli per raccogliere un set completo di dati, spesso diverse decine di migliaia. Poiché i tempi di esposizione sono relativamente lunghi utilizzando un sincrotrone, l'unico modo per studiare le reazioni veloci è stato con un laser a raggi X, "dice Chapman.
Utilizzando il cosiddetto raggio policromatico "rosa", esperimenti di cristallografia seriale con tempi di esposizione molto brevi possono ora essere condotti anche su sorgenti di radiazione di sincrotrone. Rispetto al consueto raggio monocromatico, l'ampio spettro aumenta il numero di fotoni di raggi X disponibili per eseguire una misurazione. Come scattare fotografie in una giornata molto soleggiata, le immagini possono essere realizzate con tempi di esposizione più brevi, il che significa che le reazioni rapide possono essere esaminate utilizzando sorgenti di radiazione di sincrotrone. Gli esperimenti stessi possono essere eseguiti anche con un minor numero di cristalli poiché l'ampio spettro fornisce modelli di diffrazione "colorati" più intricati con maggiori informazioni sulla struttura molecolare rispetto all'utilizzo di raggi X monocromatici di un singolo "colore".
Fino ad ora, però, non è stato possibile effettuare cristallografia seriale utilizzando il raggio rosa perché le misurazioni sono gravemente compromesse da alti livelli di fondo prodotti con fasci così forti. "Lo sfondo indesiderato nei modelli misurati viene prodotto perché i raggi X utilizzati per sondare il campione non sono solo dispersi dalle molecole nel cristallo stesso, ma anche dal portacampione e dall'aria circostante, " spiega Max Wiedorn, DESY co-autore del documento. "Il segnale effettivo misurato durante gli esperimenti con il raggio rosa è distribuito su molti "colori", il che significa che la radiazione di fondo diffusa ha un impatto nettamente più negativo sulle misurazioni rispetto a quando si utilizza la radiazione monocromatica".
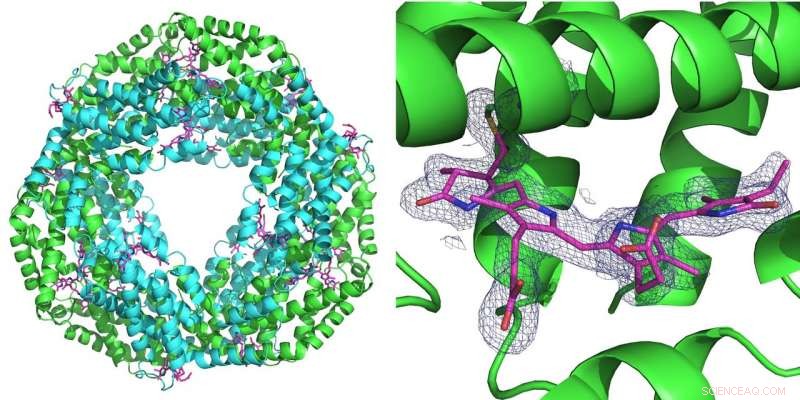
A sinistra:la prima misurazione effettuata utilizzando il nuovo set-up è stata eseguita sulla proteina ficocianina che svolge un ruolo per la fotosintesi nei cianobatteri. Forma un anello di sei doppie molecole (eterodimeri). Ad ogni eterodimero possono legarsi tre molecole di ficocianobilina (rosa). A destra:la griglia blu rappresenta la densità elettronica di una molecola di ficocianobilina legata. Entrambe le strutture sono state calcolate da sole 52 immagini di diffrazione registrate con il raggio rosa dell'Advanced Photon Source (APS) alla linea di luce BioCARS. Credito:DESY, Julia Lieske
Gli scienziati hanno quindi escogitato un nuovo assetto, che sopprime in gran parte la radiazione diffusa indesiderata. Usano un portacampioni in silicone, che non disperde i raggi X; anche, assicurano che ci sia pochissima aria nel percorso del fascio di raggi X. Per realizzare questo, il fascio di raggi X è racchiuso in un sottile tubo metallico subito prima e dietro il campione, che impedisce alla radiazione diffusa di raggiungere la telecamera a raggi X. Anche, l'aria immediatamente circostante il campione viene sostituita con un flusso di gas elio, che causa meno dispersione dell'aria. Sopprimendo la radiazione diffusa, gli scienziati sono ora riusciti per la prima volta a determinare la struttura tridimensionale di due proteine con una precisione molto elevata mediante cristallografia seriale a fascio rosa a un sincrotrone. Le misurazioni corrispondenti sono state effettuate presso la linea di luce BioCARS dell'Advanced Photon Source (APS) presso l'Argonne National Laboratory negli Stati Uniti.
"Un grande vantaggio di questo metodo è che può essere utilizzato per effettuare studi molto accurati delle strutture proteiche, ma richiede solo una frazione del materiale campione, " spiega Meents del Center for Free Electron Laser Science (CFEL) una collaborazione di DESY, l'Università di Amburgo e la società tedesca Max Planck.. "Al contrario, la piccola dimensione del campione e la velocità del metodo consentono di effettuare moltissime misurazioni in un breve lasso di tempo, per esempio nella ricerca farmaceutica, dove si vorrebbe sapere quali potenziali principi attivi si legano a una specifica proteina coinvolta in una malattia." Inoltre, il nuovo metodo richiede molto meno tempo per eseguire l'intero esperimento, che consentirà misurazioni ad alto rendimento delle strutture cristalline.
Per di più, perché le misurazioni possono essere eseguite a temperatura ambiente, cambiamenti strutturali come quelli che si verificano quando un principio attivo si lega a una proteina mirata possono essere studiati in futuro nel tempo. Il nuovo metodo raggiunge una risoluzione temporale molto elevata di 100 picosecondi, qualcosa che non era possibile ai sincrotroni con i raggi X monocromatici usati in passato. Un picosecondo è un milionesimo di milionesimo di secondo. Un raggio di luce viaggia di circa tre centimetri in 100 picosecondi.