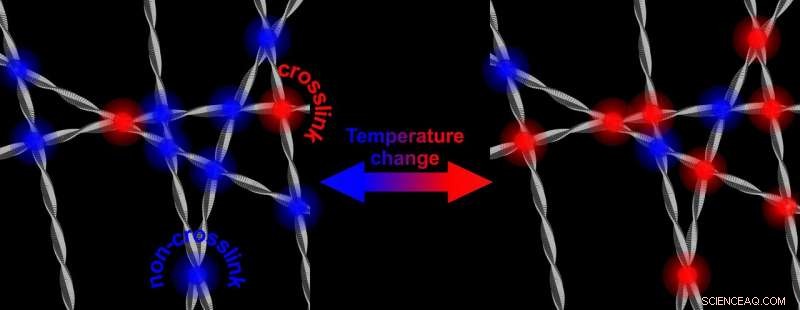
A temperature più elevate, ci sono più collegamenti incrociati che irrigidiscono la rete di fibrille proteiche. L'abbassamento della temperatura si traduce in una rete che è di nuovo meno rigida. Credito:Università di Twente
Fibrille della proteina alfa-sinucleina, che svolge un ruolo nella malattia di Parkinson, formare una rete più rigida e più forte in acqua, quando la temperatura è aumentata. Ricercatori dell'Università di Twente dimostrano che questo ha a che fare con la parte idrorepellente delle fibre che affiorano in superficie e interagiscono. Il meccanismo potrebbe anche svolgere un ruolo nell'interazione con le cellule sane. I ricercatori dell'Università di Twente ne parlano in Lettere di revisione fisica del 17 maggio.
L'alfa-sinucleina è abbondante nel nostro cervello. È noto che può ritorcersi contro di noi:nelle malattie neurodegenerative come il Parkinson, la proteina mostra un comportamento aberrante:dopo aver formato le fibrille, la proteina può formare placche. Non è ancora noto come funzioni questo meccanismo. La ricerca ora presentata dagli scienziati UT, mostra che le proprietà dell'alfa-sinucleina sono "sintonizzabili". in acqua, formeranno una rete più rigida e più forte quando la temperatura aumenta. Abbassando di nuovo la temperatura, la rete diventa di nuovo meno rigida. Sebbene tutto ciò avvenga in un intervallo di temperatura che non avrà mai luogo nel cervello, il meccanismo sottostante potrebbe fornire maggiori informazioni sul ruolo che le proteine svolgono nell'insorgenza della malattia. La rigidità regolabile è indotta dall''interazione idrofobica':la parte idrorepellente delle fibre è l'indizio.
La ricerca che ora viene presentata in Lettere di revisione fisica , mostra che il rafforzamento della rete è causato da un aumento del numero di punti di contatto delle fibrille. Questi punti di contatto si trovano tutti nelle parti idrofobiche dell'alfa-sinucleina. Il motivo per cui questo è notevole, è che la parte idrofoba normalmente è 'schermata' dagli altri due elementi costitutivi della proteina:una parte con carica elettrica e una parte anfifilica (ama sia l'acqua che i lipidi). Togliendo questo scudo e aprendo la parte idrofoba, può anche svolgere un ruolo nella malattia:questa parte è in grado di danneggiare le cellule sane.
Anche i meccanismi di difesa naturali dell'uomo possono agire contro di noi, in questo caso. Ricerche precedenti hanno mostrato che la "ripulitura" delle proteine ostili viene in genere eseguita "tagliando" la parte caricata elettricamente, togliendo così lo scudo della parte idrofoba. Le fibrille possono ora trovare punti di contatto, formano reti e attaccano le membrane cellulari. In questo modo, la protezione naturale è tolta.
La ricerca aiuta a comprendere i meccanismi, ma può anche ispirare ad es. nanotecnologi per la creazione di nuovi tipi di strutture artificiali che possono essere sintonizzate. A prima vista, l'irrigidimento della rete è noto dai polimeri, ma l'interazione idrofobica è un meccanismo completamente diverso che potrebbe essere utilizzato anche nelle strutture artificiali.