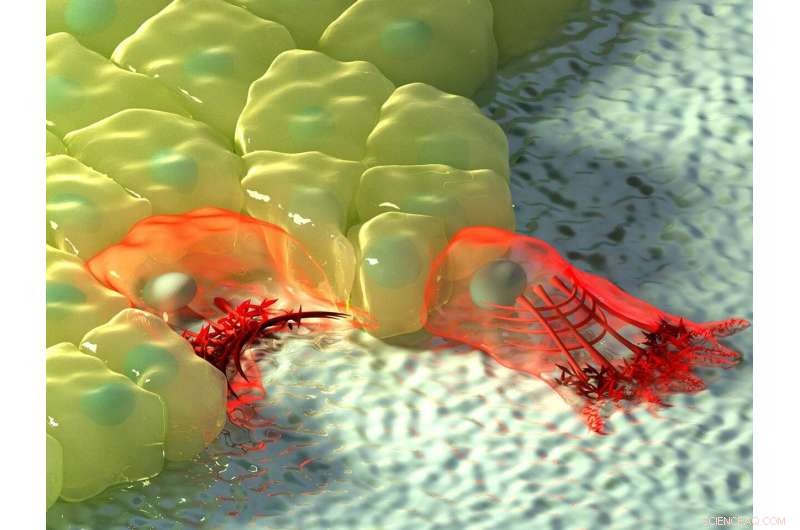
La figura sopra mostra un'illustrazione artistica delle celle nelle regioni di curvatura negativa (sinistra) e positiva (destra). A curvatura negativa, il flusso di actina si sposta verso il cavo di actina al bordo della cellula, rappresentato dall'aumento dell'intensità del colore, e il cavo contrattile solleva il bordo sopra il substrato. A curvatura positiva, i lamellipodi si estendono dalla cellula per strisciare lungo il substrato, e queste sporgenze sono caratterizzate da un flusso retrogrado di actina verso l'interno della cellula. Credito:Istituto di Meccanobiologia, Università Nazionale di Singapore
Di fronte a terreni difficili, i veicoli fuoristrada possono passare da due a quattro ruote motrici per continuare ad andare avanti. Allo stesso modo, la migrazione cellulare può essere guidata sia dal crawling diretto alla protrusione, o da forze di trazione contrattili, ma il modo in cui la cellula passa tra questi due metodi rimane un mistero. Uno studio collaborativo condotto dal dottorando MBI Tianchi Chen e dal professor Benoit Ladoux del Mechanobiology Institute (MBI) presso la National University of Singapore, ha scoperto che la direzione in cui i filamenti di actina scorrono all'interno della cellula le consente di percepire la curvatura fisica dell'ambiente circostante, e questo flusso direzionale è l'interruttore chiave che determina quale metodo di migrazione è selezionato. Il lavoro è stato pubblicato nel numero di aprile 2019 di Fisica della natura .
Riorganizzazione del flusso di actina indotta dalla curvatura
La migrazione cellulare è un processo biologico essenziale che guida la formazione di tessuti e organi durante lo sviluppo dell'embrione, e aiuta anche a proteggere il corpo attraverso la risposta immunitaria e i meccanismi di guarigione delle ferite. I cambiamenti di forma necessari per la migrazione cellulare dipendono dall'organizzazione dinamica e dalla generazione di forza dal citoscheletro dell'actomiosina interno della cellula, che è costituito da filamenti strutturali di actina e proteine motorie contrattili della miosina.
La riorganizzazione di questi componenti consente due meccanismi di migrazione cellulare:la crescita e l'estensione delle protrusioni lamellipoidali a base di actina che consentono alla cellula di "strisciare" verso l'esterno, o la formazione di grandi cavi contrattili di actomiosina che possono tirare in avanti la cellula generando forze di trazione sul substrato. Però, il processo attraverso il quale la cellula sceglie di formare sporgenze o cavi contrattili rimane poco chiaro.
A seconda della topografia dell'ambiente fisico, le cellule possono incontrare regioni di curvatura positiva o negativa. La curvatura positiva si riferisce a una forma convessa che curva verso l'esterno, proprio come una lettera maiuscola "D", considerando che un esempio della curvatura negativa opposta può essere visto nella lettera "C", che forma una forma concava che curva verso l'interno. Osservando la migrazione delle cellule epiteliali su modelli di substrato a forma di fiore che vengono utilizzati per i test di chiusura delle ferite, un internazionale, team di ricerca multidisciplinare guidato dal Prof Ladoux in collaborazione con il Professore Associato MBI Principal Investigators Boon Chuan Low e il Professore Associato Yusuke Toyama, insieme a fisici teorici e ricercatori in Francia, Chile, Israele e Spagna hanno scoperto che nelle regioni di curvatura positiva, le cellule hanno sviluppato lamellipodia per la scansione cellulare, e nelle regioni di curvatura negativa, forti cavi di actina assemblati che seguivano il bordo concavo.
Un'ulteriore osservazione della dinamica dell'actina in tempo reale utilizzando la microscopia a cellule vive ha rivelato una differenza nella direzione del flusso di actina alle due curvature. In lamellipodia indotta da curvatura positiva, il flusso di actina era retrogrado, cioè lontano dalla membrana cellulare nella direzione opposta alla sporgenza. Al contrario, a curvature negative il flusso di actina era anterogrado, cioè verso la membrana cellulare dove si trovava il cavo actina.
Questo flusso anterogrado guida l'assemblaggio di distinti, strutture di actina polarizzata in queste regioni di curvatura negativa. Il cavo actina sul bordo concavo si trova nella parte anteriore, seguito da fibre di actina trasversali che sono orientate nella stessa direzione del cavo di actina, e sul retro della rete ci sono fibre di actina radiali orientate a 90 gradi rispetto al cavo di actina. interessante, la formazione di queste strutture di actina polarizzata in risposta alla curvatura negativa è stata osservata in singole cellule e fogli cellulari che migrano su una superficie 2-D, e in cellule incorporate in reti fibrose 3-D. Mentre questi risultati hanno confermato l'esistenza di due meccanismi di migrazione cellulare, c'era ancora una domanda aperta su come le cellule fossero in grado di percepire la curvatura dell'ambiente.
Fortunatamente, l'imaging di cellule vive ha fornito ai ricercatori un potenziale indizio:l'interruttore nella direzione del flusso di actina a seconda della curvatura potrebbe potenzialmente essere il "sensore" per cambiare la modalità di migrazione. Ciò è stato confermato mediante placcatura di cellule epiteliali su una superficie micromodellata rivestita con un substrato adesivo, che era punteggiato da toppe circolari non aderenti. Quando il foglio della cella ha incontrato un cerchio non aderente, sporgenze lamellipodial strisciano intorno al cerchio, tirando le cellule in avanti sul substrato adesivo. Questo ha creato automaticamente una forma concava attraverso il cerchio non aderente, che ha causato un rapido cambiamento nella direzione del flusso di actomiosina da retrogrado ad anterogrado, conseguente assemblaggio di un cavo actina e un interruttore nel meccanismo di migrazione. Il cavo contrattile può sollevare il bordo della cellula sopra il cerchio non aderente, consentendo la migrazione del foglio cellulare per continuare.
Mentre le cellule contengono sensori di curvatura nella loro membrana, come le proteine BAR, questi consentono solo il rilevamento della curvatura a livello molecolare. Essenzialmente, la dimensione di queste proteine sensore significa che possono rilevare solo la curvatura nelle loro immediate vicinanze su una scala di nanometri, non a livello dell'intera cellula. Però, questo studio rivela come le cellule possono percepire cambiamenti di curvatura di dimensioni cellulari più grandi su una scala fino a decine di micrometri, attraverso l'adattamento dinamico del flusso di actina.
Questa capacità consente alla cellula di selezionare un meccanismo appropriato per continuare la migrazione, anche di fronte a diversi cambiamenti nell'ambiente fisico, proprio come un veicolo fuoristrada può passare dalla trazione a due e quattro ruote motrici a seconda del terreno. Con la nuova conoscenza di questo flussostato di actina, gli scienziati potrebbero essere in grado di capire meglio come le cellule possono continuare la migrazione durante la guarigione delle ferite, o in situazioni in cui la migrazione può essere dannosa come la progressione metastatica del cancro.